题目内容
(1)分析下列反应的化学方程式,是氧化还原反应的用双线桥法标出电子转移的方向和数目,指出被氧化和被还原的元素.
①Cl2+SO2+2H2O=H2SO4+2HCl ;
②NaOH+HCl═NaCl+H2O .
(2)分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目.
①BaCl2+Na2SO4═BaSO4↓+2NaCl ;
②Fe+2HCl═FeCl2+H2↑ .
①Cl2+SO2+2H2O=H2SO4+2HCl
②NaOH+HCl═NaCl+H2O
(2)分析下列反应的化学方程式,是氧化还原反应的用单线桥法标出电子转移的方向和数目.
①BaCl2+Na2SO4═BaSO4↓+2NaCl
②Fe+2HCl═FeCl2+H2↑
考点:氧化还原反应
专题:氧化还原反应专题
分析:(1)①该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,得电子的反应物是氧化剂、失电子的反应物是还原剂,氧化剂被还原、还原剂被氧化,还原剂对应的产物是氧化产物;
②中和反应中没有元素的化合价变化;
(2)①复分解反应,没有元素的化合价变化;
②该反应中,铁失电子化合价升高,H得电子化合价降低,所以铁是还原剂,HCl是氧化剂,转移电子数为2e-.
②中和反应中没有元素的化合价变化;
(2)①复分解反应,没有元素的化合价变化;
②该反应中,铁失电子化合价升高,H得电子化合价降低,所以铁是还原剂,HCl是氧化剂,转移电子数为2e-.
解答:
解:(1)①该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,所以Cl2是氧化剂、SO2是还原剂,则被氧化的元素是S元素,还原剂对应的产物H2SO4是氧化产物,其转移电子数是2,转移电子数目和方向为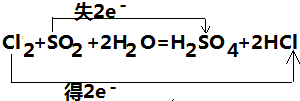 ,
,
故答案为: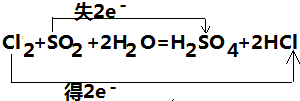 、Cl元素被还原、S元素被氧化;
、Cl元素被还原、S元素被氧化;
②NaOH+HCl═NaCl+H2O中,没有元素的化合价变化,为非氧化还原反应,故答案为:非氧化还原反应;
(2)①BaCl2+Na2SO4═BaSO4↓+2NaCl中,没有元素的化合价变化,为非氧化还原反应,故答案为:非氧化还原反应;
②该反应中,铁失电子化合价升高,H得电子化合价降低,所以铁是还原剂,HCl是氧化剂,转移电子数为2e-,用单线桥法标出电子转移的方向和数目为 故答案为:
故答案为: ;
;
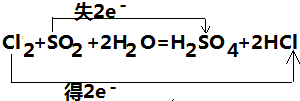 ,
,故答案为:
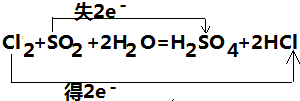 、Cl元素被还原、S元素被氧化;
、Cl元素被还原、S元素被氧化;②NaOH+HCl═NaCl+H2O中,没有元素的化合价变化,为非氧化还原反应,故答案为:非氧化还原反应;
(2)①BaCl2+Na2SO4═BaSO4↓+2NaCl中,没有元素的化合价变化,为非氧化还原反应,故答案为:非氧化还原反应;
②该反应中,铁失电子化合价升高,H得电子化合价降低,所以铁是还原剂,HCl是氧化剂,转移电子数为2e-,用单线桥法标出电子转移的方向和数目为
 故答案为:
故答案为: ;
;
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重氧化还原反应转移电子表示方法的考查,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
关于下列各装置图的叙述中,正确的是( )


| A、装置①阳极有红色物质析出 |
| B、装置②的总反应为Cu+2Fe3+=Cu2++2Fe2+ |
| C、装置③中a为负极,发生的电极反应式为H2+2OH--2e-=2H2O |
| D、用装置④精炼铜,则a极为纯铜,电解质溶液可为CuSO4溶液 |
下列反应所得溶液中一定只含一种溶质的是( )
| A、向NaOH溶液中通入CO2 |
| B、向Ca(OH)2溶液中通入Cl2 |
| C、向蒸馏水中加入少量金属Na |
| D、向MgSO4溶液中滴入NaOH溶液 |
下列各组离子能大量共存于同一溶液中的是( )
| A、Ba2+、Mg2+、Cl-、CO32- |
| B、Fe3+、K+、I-、SO42- |
| C、K+、NH4+、NO3-、OH- |
| D、Al3+、NH4+、NO3-、Cl- |
下列变化中,需加氧化剂才能实现的是( )
| A、NaClO→NaCl |
| B、Na2O2→O2 |
| C、C→CO2 |
| D、CaO→Ca(OH)2 |
正确表示下列反应的离子反应方程式为( )
A、NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-
| ||||
| B、Fe溶于足量硝酸:Fe+2H+﹦Fe2++H2↑ | ||||
| C、向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ | ||||
| D、醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O |
某实验报告记录了如下数据,其中数据合理的是( )
| A、用温度计测量出酒精的沸点为78.5℃ |
| B、用50mL量筒量取23.00 mL浓盐酸 |
| C、用广泛pH试纸测得氯水的pH值为2.1 |
| D、用托盘天平称量氧化铜粉末为11.70g |
 氧化还原是常见的反应类型,根据信息回答以下问题:
氧化还原是常见的反应类型,根据信息回答以下问题: