题目内容
铁的单质和化合物在实验和实际生产中都有重要作用.
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
(1)B装置中反应的化学方程式 .
(2)A中溶液变红的原因是 .
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 .
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液.
实验说明,Fe3+ 与SCN-生成红色Fe(SCN)3的反应 可逆反应(是或不是).
(4)该同学根据实验猜想,SCN-可能被氯水氧化.查资料得知SCN-的电子式为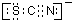 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为 个.
②若要检验产物中含有SO42-,常用的化学试剂是 (写试剂名称).
Ⅱ.①高铁电池因原料丰富、绿色环保而倍受关注.Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为 极,电极反应式为 .
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.请说明其原理 .
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
| 操作 | 现象 |
 | 现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液.
实验说明,Fe3+ 与SCN-生成红色Fe(SCN)3的反应
(4)该同学根据实验猜想,SCN-可能被氯水氧化.查资料得知SCN-的电子式为
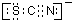 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;①上述反应中,0.5molSCN-被氧化时转移的电子总数为
②若要检验产物中含有SO42-,常用的化学试剂是
Ⅱ.①高铁电池因原料丰富、绿色环保而倍受关注.Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,该极电极为
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.请说明其原理
考点:铁的化学性质,铁的氧化物和氢氧化物
专题:实验设计题
分析:(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,据此答题;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,据此答题;
②依据反应现象判断存在化学平衡;
(4)①根据SCN-的电子式为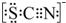 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量;
②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,据此答题;
(5)①放电生成FeOOH,依据元素化合价分析,铁元素化合价降低发生还原反应,为原电池的正极;
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,高铁酸钠具有强氧化性,杀菌消毒,被还原的产物可以生成氢氧化铁胶体具有吸附悬浮杂质的作用,可以净水凝聚等.
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,据此答题;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,据此答题;
②依据反应现象判断存在化学平衡;
(4)①根据SCN-的电子式为
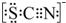 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量;
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应的化学方程式可以计算出电子转移的物质的量;②加入用盐酸酸化的BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子,其中硫显+6价,而原来SCN-中硫显-2价,所以被氧化的元素为硫元素,据此答题;
(5)①放电生成FeOOH,依据元素化合价分析,铁元素化合价降低发生还原反应,为原电池的正极;
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,高铁酸钠具有强氧化性,杀菌消毒,被还原的产物可以生成氢氧化铁胶体具有吸附悬浮杂质的作用,可以净水凝聚等.
解答:
解:(1)B装置是用来吸收氯气尾气的,根据元素守恒和电荷守恒可以写出离子方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,
故答案为:Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,故答案为:Fe3+;
②Fe3+ 与SCN-生成红色Fe(SCN)3的反应是可逆反应,存在化学平衡;
故答案为:是;
(4)①根据SCN-的电子式为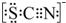 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知0.5molSCN-被氧化要转移8mol电子,电子总数为8NA,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知0.5molSCN-被氧化要转移8mol电子,电子总数为8NA,
故答案为:8NA;
②加入用盐酸酸化后,再加入BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子;
故答案为:盐酸、氯化钡溶液;
(5)①Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,铁元素化合价降低,被还原发生还原反应,是原电池正极,该极电极为正极,电极反应为:FeO42-+3e-+3H2O=FeOOH+5OH-;
故答案为:正;FeO42-+3e-+3H2O=FeOOH+5OH-;
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,高铁酸钠具有强氧化性,杀菌消毒,被还原的产物可以生成氢氧化铁胶体具有吸附悬浮杂质的作用,可以净水凝聚等;
故答案为:Na2FeO4具有强氧化性,能够杀菌消毒,还原产物Fe3+ 水解生成氢氧化铁胶体能够凝聚水中的悬浮物并能够吸附色素达到净水的目的.
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化铁溶液,呈红色,
故答案为:Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红;
(3)①A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,应当是氢氧化铁固体,所以原溶液中应当有Fe3+,故答案为:Fe3+;
②Fe3+ 与SCN-生成红色Fe(SCN)3的反应是可逆反应,存在化学平衡;
故答案为:是;
(4)①根据SCN-的电子式为
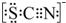 可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知0.5molSCN-被氧化要转移8mol电子,电子总数为8NA,
可知,SCN-中碳显+4价,硫显-2价,氮显-3价,碳已经是最高正价了,SCN-与Cl2反应生成硫酸根和硝酸根还有二氧化碳,所以它们反应的化学方程式为:SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,此反应中电子转移数目为16,即由方程式可知0.5molSCN-被氧化要转移8mol电子,电子总数为8NA,故答案为:8NA;
②加入用盐酸酸化后,再加入BaCl2溶液,产生白色沉淀,说明白色沉淀为硫酸钡,即溶液中有硫酸根离子;
故答案为:盐酸、氯化钡溶液;
(5)①Zn-K2FeO4碱性电池的某电极的放电产物为FeOOH,铁元素化合价降低,被还原发生还原反应,是原电池正极,该极电极为正极,电极反应为:FeO42-+3e-+3H2O=FeOOH+5OH-;
故答案为:正;FeO42-+3e-+3H2O=FeOOH+5OH-;
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,高铁酸钠具有强氧化性,杀菌消毒,被还原的产物可以生成氢氧化铁胶体具有吸附悬浮杂质的作用,可以净水凝聚等;
故答案为:Na2FeO4具有强氧化性,能够杀菌消毒,还原产物Fe3+ 水解生成氢氧化铁胶体能够凝聚水中的悬浮物并能够吸附色素达到净水的目的.
点评:本题是实验方案的综合题,综合性较强,其中涉及到了离子的检验、氧化还原的离子方程式的书写、实验步骤的设计、化学计算、原电池原理分析等知识点,解题的关键是要掌握元素化合物的基础知识及实验基本操作要求,题目难度中等.

练习册系列答案
相关题目
现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
| A、萃取法 | B、升华法 |
| C、蒸馏法 | D、分液法 |
通常状况下,下列物质为气体的是( )
| A、甲苯 | B、溴乙烷 |
| C、四氯化碳 | D、2-甲基丙烷 |
 国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H18O4 |
| B、分子中只含有1个手性碳原子 |
| C、既能发生加聚反应,又能发生缩聚反应 |
| D、既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
 如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )
如图所示,△H1=-393.5kJ?mol-1,△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )| A、石墨和金刚石的转化是物理变化 |
| B、C(s、石墨)═C(s、金刚石)△H=+1.9kJ?mol-1 |
| C、金刚石的稳定性强于石墨 |
| D、断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少 |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B、配制硫酸亚铁溶液时,需将FeSO4?7H2O先溶于硝酸再用蒸馏水稀释,最后加少量铁粉 |
| C、0.1 mol?L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
下列有关化学用语表示正确的是( )
A、CO2分子比例模型: |
B、HCl的电子式为: |
| C、乙酸乙酯和葡萄糖的实验式:CH2O |
D、对硝基甲苯的结构简式: |
