题目内容
 室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol?L-1 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A、a点时,溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-?Al(OH)3 |
| B、a-b段,溶液pH增大,Al3+浓度不变 |
| C、b-c段,加入的OH-主要用于生成Al(OH)3沉淀 |
| D、d点时,Al(OH)3沉淀开始溶解 |
考点:真题集萃,镁、铝的重要化合物
专题:元素及其化合物
分析:A.硫酸铝为强酸弱碱盐,水解显酸性;
B.a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
C.b-c段,pH变化不大;
D.c点后pH发生突变,NaOH过量.
B.a-b段,发生氢离子与碱中和反应,且溶液总体积增大;
C.b-c段,pH变化不大;
D.c点后pH发生突变,NaOH过量.
解答:
解:A.硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+,故A错误;
B.a-b段,发生H++OH-═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故B错误;
C.b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故C正确;
D.c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选C.
B.a-b段,发生H++OH-═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故B错误;
C.b-c段,pH变化不大,主要发生Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀,故C正确;
D.c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选C.
点评:本题为2014年安徽高考化学试题,侧重盐类水解及复分解反应的考查,注意氢氧化铝的两性及图中c点pH突变为解答的关键,明确b→c段中铝离子过量,题目难度不大.

练习册系列答案
相关题目
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法不正确的是( )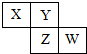
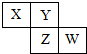
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |
38Sr(锶)与37Rb(铷)是同周期的相邻元素,下列有关锶的说法错误的是( )
| A、38Sr是第3周期ⅡA族元素 |
| B、Sr的离子半径比Ar的原子半径大 |
| C、Sr的碳酸盐受热会分解 |
| D、Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱 |
下列说法中,正确的是( )
| A、将NO2通入FeSO4溶液中不会有明显现象 |
| B、2L 0.5mol/L的盐酸和1L 0.5mol/L的硫酸PH相等 |
| C、饱和氯水中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下反应的△H不相同 |
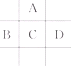 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题: