题目内容
2Na2O2+2H2O═4NaOH+O2↑,生成标况下1.12L O2时,转移 mol电子.
考点:氧化还原反应的计算
专题:
分析:该反应Na2O2中O元素化合价由-1价变为0价和-2价,所以Na2O2既是氧化剂又是还原剂,O2是氧化产物,根据O2和转移电子之间的关系式计算转移电子的物质的量.
解答:
解:该反应Na2O2中O元素化合价由-1价变为0价和-2价,所以Na2O2既是氧化剂又是还原剂,O2是氧化产物,
设转移电子的物质的量为x,
2Na2O2+2H2O═4NaOH+O2↑转移电子
22.4L 2mol
1.12L x
22.4L:2mol=1.12L:x
x=
=0.1mol,
故答案为:0.1.
设转移电子的物质的量为x,
2Na2O2+2H2O═4NaOH+O2↑转移电子
22.4L 2mol
1.12L x
22.4L:2mol=1.12L:x
x=
| 2mol×1.12L |
| 22.4L |
故答案为:0.1.
点评:本题考查氧化还原反应的计算,明确过氧化钠中O元素化合价变化是解本题关键,利用方程式中各个物理量之间的关系式解答即可,题目难度不大.

练习册系列答案
相关题目
关于阿伏加德罗常数的说法正确的是( )
| A、0.1 L 3.0 mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
| B、9g SiO2晶体中含有的硅氧键数目为0.3NA |
| C、30 g甲醛中含共用电子对总数为4NA |
| D、10 g 46%的乙醇水溶液中所含H原子个数为0.6NA |
下列说法中正确的是( )
| A、用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味 |
| B、用排水集气法便可以收集到纯净的氯气 |
| C、干燥的氯气有漂白性 |
| D、自来水常用氯气来杀菌、消毒 |
四种短周期元素W、X、Y、Z 的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1:2,X和Y的电子数之差为4.下列说法正确的是( )
| A、原子半径大小:Z>Y>X>W |
| B、由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C、W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D、Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
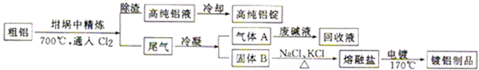
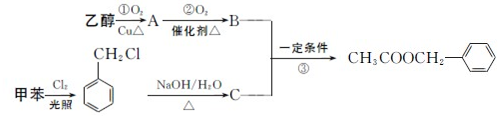
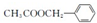 是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下:
是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成,其中一种合成路线如下: