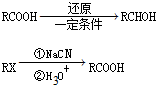
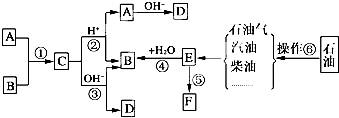
题目内容
8NH3+3Cl2═N2+6NH4Cl,被氧化的NH3与未被氧化的NH3的质量比为 .
考点:氧化还原反应
专题:
分析:该反应中N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,由N元素化合价可知,被氧化的氨气生成N2,未被氧化的NH3生成NH4Cl,根据N元素守恒结合方程式确定被氧化的NH3与未被氧化的NH3的质量比.
解答:
解:反应8NH3+3Cl2═N2+6NH4Cl中,由N元素化合价可知,被氧化的氨气生成N2,未被氧化的NH3生成NH4Cl,根据N元素守恒,被氧化的NH3与未被氧化的NH3的物质的量之比为2:6=1:3,故被氧化的NH3与未被氧化的NH3的质量之比为1:3,故答案为:1:3.
点评:本题考查氧化还原反应有关计算,比较基础,有利于基础知识的巩固.

练习册系列答案
相关题目
下列有关氯水的叙述,正确的是( )
| A、氯气有毒,可以毒死细菌、病毒,所以可以用于自来水消毒 |
| B、新制氯水可使紫色石蕊试液先变红后褪色 |
| C、氯水光照时有气泡逸出,该气体的主要成分是氯气 |
| D、氯水放置数天后,其酸性逐渐减弱 |
下列有关实验中安全操作或事故处理中正确的是 ( )
| A、将100g水倒入100g 98% 硫酸溶液中配制成49% 的硫酸溶液 |
| B、给试管里的液体加热时,液体体积不得超过试管容积的1/3 |
| C、使用胶头滴管时,应将滴管尖嘴伸进试管内,以免液体外流 |
| D、不小心将浓硫酸洒到桌面上,应先用抹布擦,再用大量水冲洗 |
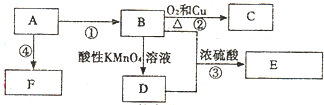
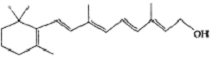 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.