题目内容
17.现有一定量含有Na2O杂质的Na2O2试样.(可供选用的反应物只有CaCO3固体,6mol•L-1盐酸和蒸馏水)(一)请从如图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度.

请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH.
(2)应选用的装置是(只要求写出图中装置的标号)⑤②①④
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略)(G)接(D)(C)(B)(A)接(F)
(二)由题中所提供的药品和装置,还可通过另一种方法来测定试样中过氧化钠的纯度
(1)应选用的装置是⑤⑧②⑥⑦,连接顺序应是:G→L→M→D→C→H→I→J.
(2)装置⑧的作用是除去二氧化碳中混有的HCl,装置②的作用是除去二氧化碳中混有的水蒸气,装置⑦中碱石灰的作用是防止空气中的二氧化碳和水蒸气与过氧化钠反应,消除对实验测定的影响.
(3)装置⑥中发生反应的化学方程式是:2Na2O2+2CO2═2Na2CO3+O2.
(4)若开始时测得样品的质量为2.0g,反应结束后测得生成气体的体积为224mL(标准状况),计算出试样中Na2O2的纯度为:88%.
分析 (一)(1)Na2O2和水反应生成氢氧化钠和氧气,Na2O和水反应生成氢氧化钠;
(2)根据氧化钠和过氧化钠与水反应的区别:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,可以用排水量气法测定氧气的体积,进而确定过氧化钠的量及其百分含量;
(3)装置的组装顺序:固体混合物与水反应,用排水量气法测定氧气的体积;其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积;
(二)(1)CaCO3固体和6mol•L-1盐酸反应生成二氧化碳,含有杂质HCl和水蒸汽,通过饱和碳酸氢钠溶液除掉HCl,通过浓硫酸干燥得到纯净的二氧化碳,然后与过氧化钠反应,通过质量的变化测定试样中过氧化钠的纯度;
(2)CaCO3固体和盐酸反应生成的二氧化碳中含有杂质HCl和水蒸汽,通过饱和碳酸氢钠溶液除掉HCl,通过浓硫酸出去水蒸气,过氧化钠和空气中水、二氧化碳均能发生反应,对实验测定造成影响;
(3)装置⑥中发生的反应是二氧化碳和过氧化钠反应;
(4)生成的气体是氧气,带入n=$\frac{V}{{V}_{m}}$计算氧气的物质的量,根据化学方程式可知n(Na2O2)=2n(O2),带入m=nM计算过氧化钠的质量,最后求算纯度.
解答 解:(一)(1)氧化钠和过氧化钠均能和水反应,Na2O2和水反应生成氢氧化钠和氧气,Na2O和水反应生成氢氧化钠,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH,
故答案为:2Na2O2+2H2O=4NaOH+O2↑、Na2O+H2O=2NaOH;
(2)实验的原理是:过氧化钠和水反应生成氢氧化钠溶液的同时,还会生成氧气,但氧气中会有水蒸气,要用浓硫酸吸水,然后可以用排水量气法测定氧的体积,进而确定过氧化钠的量及其百分含量,故可选择的装置为⑤①④即可,
故答案为:⑤②①④;
(3)用排水量气法测定氧体的体积时,其中盛水的试剂瓶导管一定要短进长出,大气压强原理将水排出,量筒中水的体积就是生成氧气的体积,故连接次序:(G)接(D)(C)(B)(A)接(F),
故答案为:(G)接(D)(C)(B)(A)接(F);
(二)(1)CaCO3固体和6mol•L-1盐酸反应生成二氧化碳,含有杂质HCl和水蒸汽,通过饱和碳酸氢钠溶液除掉HCl,通过浓硫酸干燥得到纯净的二氧化碳,然后与过氧化钠反应,通过质量的变化测定试样中过氧化钠的纯度,因此选用的仪器有⑤⑧②⑥⑦,顺序为G→L→M→D→C→H→I→J,
故答案为:⑤⑧②⑥⑦;G→L→M→D→C→H→I→J;
(2)CaCO3固体和盐酸反应生成的二氧化碳中含有杂质HCl和水蒸汽,通过饱和碳酸氢钠溶液除掉HCl,通过浓硫酸出去水蒸气,过氧化钠和空气中水、二氧化碳均能发生反应,对实验测定造成影响,碱石灰可以吸收空气中的水蒸气和二氧化碳,防止空气中的二氧化碳和水蒸气与过氧化钠反应,消除对实验测定的影响,
故答案为:除去二氧化碳中混有的HCl;除去二氧化碳中混有的水蒸气;防止空气中的二氧化碳和水蒸气与过氧化钠反应,消除对实验测定的影响;
(3)装置⑥中发生的反应是二氧化碳和过氧化钠反应,化学方程式为2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)n(O2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,由2Na2O2+2CO2═2Na2CO3+O2可知n(Na2O2)=2n(O2)=0.02mol,则m(Na2O2)=0.02mol×88×g/mol=1.76g,试样中Na2O2的纯
度为$\frac{1.76g}{2.0g}$×100%=88%,
故答案为:88%.
点评 本题考查了过氧化钠的性质,涉及实验原理、实验仪器选择、实验方案的制定,难度中等,掌握实验原理是制定实验方案,从而选择实验仪器的基础.

| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
| A. | 定容时,因不慎使液面高于容量的刻度线,需重新配制 | |
| B. | 焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后进行实验 | |
| C. | 将新制氯水滴入紫色石蕊溶液中,可以看到石蕊溶液先变红后褪色 | |
| D. | 取少量晶体放入试管中,加入适量稀NaOH溶液,在试管口用湿润的红色石蕊试纸检验,若试纸变蓝,则可证明该晶体中含有NH4+ |
| A. | 不能让小学生咬铅笔头,否则会引起铅中毒 | |
| B. | 食用碱用于面包加工,可以使面包疏松 | |
| C. | 铝合金用作门窗框架,这是利用了合金硬度大的特征 | |
| D. | 烧碱和冰醋酸均为电解质 |
| A. | 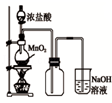 如图中:MnO2过量,盐酸能全部消耗 | B. | 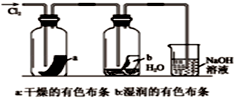 如图中:湿润的有色布条能褪色 | ||
| C. | 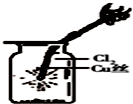 如图中:生成棕色的烟 | D. | 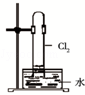 如图中:水可以充满试管 |
| A. | S2- | B. | S4O62- | C. | S2O42- | D. | SO32- |
| A. | 氨溶于的喷泉实验,说明氨气极易溶于水 | |
| B. | 常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性 | |
| C. | 氯气可使湿润的红色布条褪色,说明次氯酸具有漂白性 | |
| D. | 向蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸有吸水性 |
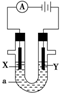 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: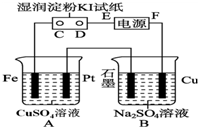 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.