题目内容
下列溶液中,微粒的物质的量浓度正确的是( )
| A、在Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
| B、常温时,将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)=0.2mol |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.根据溶液的电荷守恒判断;
B.pH=1的醋酸和pH=13的NaOH中c(H+)=c(OH-),混合后醋酸过量,溶液呈酸性;
C.根据物料守恒判断;
D.溶液体积未知,不能确定物质的量.
B.pH=1的醋酸和pH=13的NaOH中c(H+)=c(OH-),混合后醋酸过量,溶液呈酸性;
C.根据物料守恒判断;
D.溶液体积未知,不能确定物质的量.
解答:
解:A.Na2CO3溶液中存在电荷守恒,阳离子所带电荷等于阴离子所带电荷,为c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c(HCO3-),故A正确;
B.醋酸为弱电解质,不能完全电离,pH=1的醋酸和pH=13的NaOH中c(H+)=c(OH-),混合后醋酸过量,溶液呈酸性,则c(H+)>c(OH-),由电荷守恒可知c(CH3COO-)>c(Na+),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.NaHCO3溶液中存在物料守恒,应为c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C错误;
D.溶液体积未知,不能确定物质的量,故D错误.
故选AB.
B.醋酸为弱电解质,不能完全电离,pH=1的醋酸和pH=13的NaOH中c(H+)=c(OH-),混合后醋酸过量,溶液呈酸性,则c(H+)>c(OH-),由电荷守恒可知c(CH3COO-)>c(Na+),离子浓度大小顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.NaHCO3溶液中存在物料守恒,应为c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),故C错误;
D.溶液体积未知,不能确定物质的量,故D错误.
故选AB.
点评:本题考查离子浓度大小比较,为高频考点,侧重于学生的分析能力的考查,答题时注意把握电荷守恒、物料守恒的应用,注意醋酸为弱酸,把握pH与浓度的关系即可解答,题目难度中等.

练习册系列答案
相关题目
下列关于胶体与溶液的说法正确的是( )
| A、胶体与溶液的本质区别在于能否发生丁达尔效应 |
| B、利用滤纸可以分离胶体与溶液 |
| C、向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体 |
| D、蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、含4.8g 碳元素的石墨晶体中的共价键数是0.8NA |
| B、标准状况下,11.2LCO和N2的混合气体中,含有的原子数为NA |
| C、1mol的羟基(-OH)与1mol的氢氧根离子(OH-)所含电子数均为9NA |
| D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反 应后的生成物分子数为NA |
下列说法不正确的是( )
| A、制阿司匹林时用水洗涤产品,而在制摩尔盐时用酒精洗涤产品 |
| B、纸层析法通常把不与水混溶的有机溶剂作为固定相 |
| C、中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用 |
| D、减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相对,以便于吸滤 |
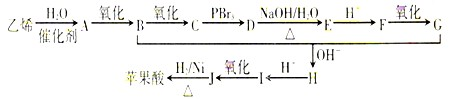
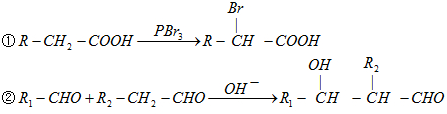

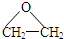 ),而且原子利用率为100%,为绿色化学,写出反应方程式
),而且原子利用率为100%,为绿色化学,写出反应方程式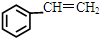 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,该氧化剂为:
、HCOOH和H2O,该氧化剂为: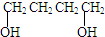 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式:
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式: 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液,选择甲基橙作指示剂.请填写下列空白: