题目内容
11.烟气中NOx是NO和NO2的混合物.(1)根据废气排放标准,1m3烟气最高允许含400mgNOx.若NOx中NO质量分数为0.85,则1m3烟气中最高允许含NO0.25L(标准状况,保留2位小数).
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16g/mL)作为NOx吸收剂,该碳酸钠溶液物质的量浓度为1.64mol/L(保留2位小数).
(3)已知:NO+NO2+Na2CO3═2NaNO2+CO2 ①
2NO2+Na2CO3═NaNO2+NaNO3+CO2 ②
1m3含2000mgNOx的烟气用质量分数为0.150的碳酸钠溶液吸收.若吸收率为80%,吸收后的烟气不符合排放标准(填“符合”或“不符合”),理由:吸收后烟气总体积减小,NOx含量仍超过400mg/m3.
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3═3NO2+H2O,当烟气中n(NO):n(NO2)=2:3时,吸收率最高.1m3烟气含2000mgNOx,其中n(NO):n(NO2)=9:1.为了达到最高吸收率,1m3烟气需用硝酸的物质的量0.035mol(保留3位小数).
分析 (1)根据NO的质量分数计算NO的质量,在根据n=$\frac{m}{M}$计算NO的物质的量,根V=nVm计算NO的体积;
(2)根据c=$\frac{1000ρω}{M}$计算碳酸钠溶液物质的量浓度;
(3)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3;
(4)(i)根据n(NO):n(NO2)=9:1,结合1m3烟气中含有的二者质量计算烟气中n(NO)、n(NO2),令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,利用吸收率最高时比例关系列方程计算.
解答 解:(1)NO的最大质量为400mg×0.85=340mg,NO的体积为$\frac{0.34g}{30g/mol}$×22.4L/mol=0.25L,故答案为:0.25;
(2)该碳酸钠溶液物质的量浓度为$\frac{1000×1.16×0.15}{106}$mol/L=1.64mol/L,故答案为:1.64;
(3)未被被吸收的NOx的质量为2000mg×(1-80%)=400mg,因吸收后烟气总体积减小,NOx含量仍超过400mg/m3,故不符合,故答案为:不符合,吸收后烟气总体积减小,NOx含量仍超过400mg/m3;
(4)由于n(NO):n(NO2)=9:1,则30×n(NO)+$\frac{1}{9}$n(NO)×46=2,解得n(NO)=0.057mol,令需要加入的硝酸为2x,根据方程式NO+2HNO3→3NO2+H2O可知,反应的n(NO)=x、生成n(NO2)=3x,则(0.057-x):($\frac{1}{9}$×0.057+3x)=2:3,解得x=0.0176mol,故n(HNO3)=2x=0.035mol,
故答案为:0.035mol.
点评 本题考查物质的量浓度计算、物质含量的有关计算等,难度较大,(3)为易错点,容易忽略体积变化,(4)中的计算是难点,数据计算量较大.

| A. | 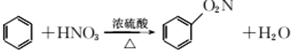 | |
| B. | CH2═CH2+Br2-→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
| A. | 氧化铝-耐火材料 | B. | 食醋-除水垢 | C. | 漂白粉-漂白织物 | D. | 明矾-净化水 |
①2:7②5:4③4:5④7:2.

| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
| A. | NaOH溶液与醋酸反应 | B. | KOH溶液与稀盐酸反应 | ||
| C. | Ba(OH)2溶液与稀硫酸反应 | D. | Cu(OH)2与稀硝酸反应 |
| A. | (CH3)2=CHCH3和(CH3)2CHCH=CH2 | B. | CH2=C(CH3)2和CH3CH=CHCH3 | ||
| C. | CH3CH2CH2COOH 和CH3COOCH2CH2 | D. | CH3CH2OH和CH3OCH3 |
 室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )
室温下,在0.2mol•L-1 Al2(SO4)3溶液中,逐滴加入1.0mol•L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如图,下列有关说法正确的是( )| A. | 0→c段,发生反应的离子方程式为:Al3++4OH-═[Al(OH)4]- | |
| B. | a-b段,溶液pH增大,Al3+浓度不变 | |
| C. | b-c段,加入的OH-主要用于生成Al(OH)3沉淀 | |
| D. | d点时,Al(OH)3沉淀开始溶解 |