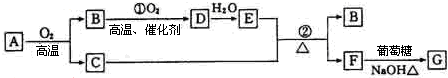
题目内容
1.下列有机反应方程式书写正确的是( )| A. | 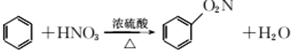 | |
| B. | CH2═CH2+Br2-→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| D. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl |
分析 A.硝基苯中C与N成键;
B.发生加成反应,乙烯中两个C上各引入一个Br原子;
C.发生酯化反应生成乙酸乙酯;
D.发生取代反应生成一氯甲烷与HCl.
解答 解:A.制备硝基苯的反应为 ,故A错误;
,故A错误;
B.发生的加成反应为CH2═CH2+Br2-→CH2BrCH2Br,故B错误;
C.发生酯化反应为CH3COOH+CH3CH2OH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,故C错误;
D.发生取代反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故D正确;
故选D.
点评 本题考查有机化学反应书写及有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重加成、取代反应的考查,题目难度不大.

练习册系列答案
相关题目
11.废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4•5H2O)及副产物ZnO.制备流程图如图:
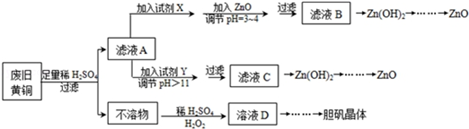
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请回答下列问题:
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-.如图表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| Fe3+ | Fe2+ | Zn2+ | |
| 开始沉淀的pH | 1.1 | 5.8 | 5.9 |
| s沉淀完全的pH | 3.0 | 8.8 | 8.9 |
(1)试剂X可能是H2O2.
(2)加入ZnO调节pH=3~4的目的是降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去.
(3)由不溶物生成溶液D的化学方程式为Cu+H2O2+H2SO4=CuSO4+2H2O.
(4)由溶液D制胆矾晶体包含的主要操作步骤是蒸发浓缩、冷却结晶、抽滤.
(5)下列试剂可作为Y试剂的是B.
A.ZnO B.NaOH C.Na2CO3D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是先产生白色沉淀后溶解.
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL.已知:上述滴定过程中的离子方程式如下:2Cu2++4I-═2CuI(白色)↓+I2,I2+2S2O32-═2I-+S4O62-胆矾晶体的纯度为97.00%.
12.下列离子方程式正确的是( )
| A. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 大理石和醋酸:CO32-+2H+═H2O+CO2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 向Ba(OH)2溶液中滴加KHSO4溶液至中性:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
9.下列有关说法不正确的是( )
| A. | 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| B. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| C. | 金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 | |
| D. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁 |
16.下列溶液中Cl-的浓度与150mL0.5mol/L氯化铝溶液中的氯离子的浓度相等的是( )
| A. | 150mL1mol/L氯化镁溶液 | B. | 450mL1.5 mol/L氯酸钾溶液 | ||
| C. | 50mL1.5 mol/L氯化钾溶液 | D. | 50mL0.5 mol/L氯化铜溶液 |
13.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在常温常压下,11.2L氮气所含的原子数目为NA | |
| B. | 1.7g氨气所含分子数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2SO4溶液中含有Na+的个数为NA | |
| D. | 2g氢气所含氢原子数目为NA |
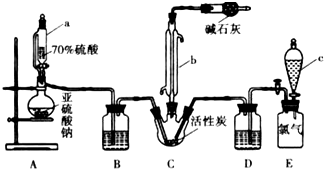 硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:
硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示: