题目内容
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)△H1
反应Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,K1的表达式为 ,若反应Ⅱ的化学平衡常数为K2,那么K1?K2= .
(2)反应1化学平衡常数K1和温度t的关系如表:
该反应的△H2 O(选项“>”、“=”、“<”)
(3)某温度下,反应1的化学平衡常数为2.225.在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2(g)和H2(g),这两种物质的起始浓度如表:
反应速率最快的是 (填“甲”、“乙”或“丙”),平衡时,H2转化率最大的是 (填“甲”、“乙”或“丙”),丙中H2的转化率为 .
(4)能判断反应Ⅰ是否达到化学平衡状态的依据是
A.容器内压强不变
B.混合气体中c(CO)不变
C.相同时间内消耗H2的速率和消耗CO 的速率相等
D.c(CO2)=c(CO)
反应Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)△H1
反应Ⅱ:CO(g)+H2O(g)?CO2(g)+H2(g)△H2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,K1的表达式为
(2)反应1化学平衡常数K1和温度t的关系如表:
| t/℃ | 700 | 800 | 850 | 1000 | 1200 |
| K1 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(3)某温度下,反应1的化学平衡常数为2.225.在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2(g)和H2(g),这两种物质的起始浓度如表:
| 起始浓度 | 甲 | 乙 | 丙 |
| c(CO2)(mol/L) | 0.01 | 0.02 | 0.02 |
| c(H2)(mol/L) | 0.01 | 0.01 | 0.02 |
(4)能判断反应Ⅰ是否达到化学平衡状态的依据是
A.容器内压强不变
B.混合气体中c(CO)不变
C.相同时间内消耗H2的速率和消耗CO 的速率相等
D.c(CO2)=c(CO)
考点:化学平衡常数的含义,化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)反应Ⅰ和反应Ⅱ是温度相同条件下方向相反的反应,平衡常数互为倒数,依据平衡常数概念计算分析;
(2)依据图表数据分析,平衡常数随温度升高增大,平衡正向进行,反应是吸热反应;
(3)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,依据化学平衡来计算平衡浓度得到平衡常数和氢气的转化率;
(4)反应Ⅰ是气体体积不变的吸热反应,平衡标志是正逆反应速率相同,各组分含量保持不变分析选项.
(2)依据图表数据分析,平衡常数随温度升高增大,平衡正向进行,反应是吸热反应;
(3)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,依据化学平衡来计算平衡浓度得到平衡常数和氢气的转化率;
(4)反应Ⅰ是气体体积不变的吸热反应,平衡标志是正逆反应速率相同,各组分含量保持不变分析选项.
解答:
解:(1)反应Ⅰ的化学平衡常数为K1,K1的表达式=
,反应Ⅰ和反应Ⅱ是温度相同条件下方向相反的反应,反应的平衡常数互为倒数,则K1?K2=1,
故答案为:
;1;
(2)由表格中温度与化学平衡常数的关系可知,温度越高,平衡常数越大,即升高温度平衡正向进行,正反应是吸热反应,△H1>0,反应Ⅱ是反应Ⅰ的逆反应,所以△H2<0,故答案为:<;
(3)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,设丙中平衡时一氧化碳的浓度为xmol/L,二氧化碳浓度为(0.02-x)mol/L,氢气的浓度为(0.02-x)mol/L,水的浓度为xmol/L,平衡常数K=
=2.225,计算得到x=0.012mol/L,即氢气的浓度为0.008mol/L,丙中氢气的转化率=
×100%=60%,
故答案为:丙;乙;60%;
(4)反应Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)△H1>0,反应是气体体积不变的吸热反应;
A.反应前后气体体积不变,反应过程中和平衡状态,容器内压强始终不变,压强不变不能说明费用达到平衡状态,故A错误;
B.混合气体中c(CO)不变,是平衡标志,故B正确;
C.相同时间内消耗H2的速率和消耗CO 的速率相等,说明正逆反应速率相同,证明反应达到平衡状态,故C正确;
D.c(CO2)=c(CO),浓度相同和起始量和变化量有关,不能说明费用达到平衡状态,故D错误;
故答案为:BC.
| c(CO)c(H2O) |
| c(CO2)c(H2) |
故答案为:
| c(CO)c(H2O) |
| c(CO2)c(H2) |
(2)由表格中温度与化学平衡常数的关系可知,温度越高,平衡常数越大,即升高温度平衡正向进行,正反应是吸热反应,△H1>0,反应Ⅱ是反应Ⅰ的逆反应,所以△H2<0,故答案为:<;
(3)丙中的二氧化碳和氢气的浓度都最大.而反应温度相同,故丙中反应速率最大;甲、丙为等效平衡,而乙中二氧化碳的浓度大于氢气的浓度,所以乙中氢气的转化率最大,设丙中平衡时一氧化碳的浓度为xmol/L,二氧化碳浓度为(0.02-x)mol/L,氢气的浓度为(0.02-x)mol/L,水的浓度为xmol/L,平衡常数K=
| x2 |
| (0.02-x)2 |
| 0.02mol/L-0.008mol/L |
| 0.02mol/L |
故答案为:丙;乙;60%;
(4)反应Ⅰ:CO2(g)+H2(g)?CO(g)+H2O(g)△H1>0,反应是气体体积不变的吸热反应;
A.反应前后气体体积不变,反应过程中和平衡状态,容器内压强始终不变,压强不变不能说明费用达到平衡状态,故A错误;
B.混合气体中c(CO)不变,是平衡标志,故B正确;
C.相同时间内消耗H2的速率和消耗CO 的速率相等,说明正逆反应速率相同,证明反应达到平衡状态,故C正确;
D.c(CO2)=c(CO),浓度相同和起始量和变化量有关,不能说明费用达到平衡状态,故D错误;
故答案为:BC.
点评:本题考查了化学平衡的分析判断,平衡计算方法的应用,平衡常数,转化率概念的计算分析,掌握基础是解题关键,题目难度中等.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
一定温度下,某一密闭且体积不变的容器内有可逆反应:A(g)+2B(g)?2C(g).该反应进行到一定限度后达到了化学平衡,不能做为判断该化学平衡标志的是( )
| A、容器内气体A的物质的量不再随时间而改变 |
| B、容器内气体C的浓度不再随时间而改变 |
| C、单位时间内生成amol物质A,同时生成3amol物质B |
| D、单位时间内生成amol物质A,同时生成2amol物质C |
下列化学反应中,不属于氧化还原反应的是( )
| A、(NH4)2Cr2O7=N2↑+Cr2O3+4H2O |
| B、2Cu+O2+CO2+H2O=Cu(OH)2CO3 |
| C、NH4NO3=N2O↑+2H2O |
| D、Cu2(OH)2CO3=2CuO+H2O+CO2↑ |
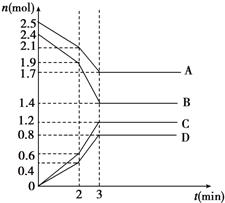 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题: