题目内容
含铁元素的物质对人体健康、生产生活都有重要作用,请完成以下填空:
(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色溶液,其离子反应方程式为 .取少量棕黄色溶液置于试管中,滴入NaOH溶液,可观察到Fe(OH)3沉淀生成,该离子方程式为 .另在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL 上述棕黄色溶液,继续加热至产生 色液体,停止加热.证明所得分散系类型的最常用的物理方法为 .
(2)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现 (“氧化性”或“还原性”).
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌,同时自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.从氧化还原角度分析,杀灭病菌充分利用了Na2FeO4的强 .(“氧化性”或“还原性”)
(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,反应后得到棕黄色溶液,其离子反应方程式为
(2)一个体重50kg的健康人含铁元素2g,Fe2+易被人体吸收,所以给贫血者补充铁时,服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收.维生素C在这个反应中表现
(3)高铁酸钠(Na2FeO4)能有效地杀灭水中的病菌,同时自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物.从氧化还原角度分析,杀灭病菌充分利用了Na2FeO4的强
考点:铁的氧化物和氢氧化物,氧化还原反应
专题:氧化还原反应专题,几种重要的金属及其化合物
分析:(1)氧化铁与盐酸反应生成氯化铁和水;氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,据此写出反应的离子方程式;根据氢氧化铁胶体的制备方法和胶体的性质进行解答;
(2)Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现;
(3)根据高铁酸钠中铁元素的化合价及题中信息来分析具有的性质.
(2)Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现;
(3)根据高铁酸钠中铁元素的化合价及题中信息来分析具有的性质.
解答:
解:(1)取少量某品牌油漆的原料Fe2O3(红棕色粉末)并加入适量盐酸,氧化铁与盐酸反应生成铁离子和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;棕黄色FeCl3溶液中滴入NaOH溶液会产生Fe(OH)3沉淀,反应的离子方程式为:Fe3++3OH-═Fe(OH)3↓;在小烧杯中加入30mL蒸馏水,加热至沸腾后,向沸水中滴入2mL氯化铁棕黄色溶液,继续加热可以获得红褐色的氢氧化铁胶体,氢氧化铁胶体具有丁达尔效应,可以利用此性质检验胶体的存在,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH-═Fe(OH)3↓;红褐色;丁达尔效应;
(2)服用维生素C可使食物中的Fe3+转化成Fe2+,Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现,所以维生素C在这个反应中做还原剂,表现还原性,
故答案为:还原性;
(3)高铁酸钠中铁元素的化合价是+6价,居于铁元素的最高价,净水过程中自身被还原成新生态的Fe(OH)3,所以Na2FeO4具有氧化性,
故答案为:氧化性.
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3++3OH-═Fe(OH)3↓;红褐色;丁达尔效应;
(2)服用维生素C可使食物中的Fe3+转化成Fe2+,Fe3+转化成Fe2+发生了还原反应,需加入还原剂才能实现,所以维生素C在这个反应中做还原剂,表现还原性,
故答案为:还原性;
(3)高铁酸钠中铁元素的化合价是+6价,居于铁元素的最高价,净水过程中自身被还原成新生态的Fe(OH)3,所以Na2FeO4具有氧化性,
故答案为:氧化性.
点评:本题考查了铁的氧化物、氢氧化物的性质、氧化还原反应的判断、氢氧化铁胶体的制备,题目难度中等,注意掌握铁的氧化物、氢氧化物的组成、性质,明确氢氧化铁胶体的制备方法及鉴别方法,能够根据化合价变化判断物质氧化性、还原性.

练习册系列答案
相关题目
硫酸铵[(NH4)2SO4]强热时分解产物为SO2、NH3、N2及H2O.根据氧化还原反应原理,不写方程式即可知道,产物中SO2与N2的体积之比为( )
| A、1:1 | B、2:1 |
| C、3:1 | D、1:3 |
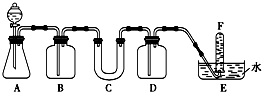 在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选择适当的化学试剂和实验用品,用图中的实验装置进行试验,证明过氧化钠可作供氧剂.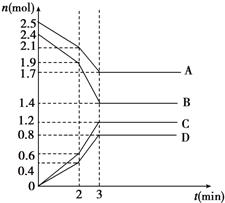 在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题:
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:完成下列问题: