题目内容
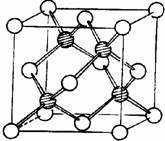 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有考点:晶胞的计算
专题:化学键与晶体结构
分析:利用均摊法确定每个冰晶胞含有的水分子个数,根据氧原子和碳原子的杂化方式以及氢键的特点,分析冰晶胞与金刚石晶胞微粒排列方式相同的原因.
解答:
解:每个冰晶胞平均占有分子个数=4+
×8+6×
=8,H2O的氧原子中含有2个σ键和2个孤电子对,金刚石中每个碳原子含有4个σ键且没有孤电子对,所以水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子中一个氧原子可以和另外2个水分子中的氢原子形成2个氢键,2个氢原子可以和另外2个水分子中的氧原子形成氢键,所以每个水分子可与相邻的4个水分子形成4个氢键,导致冰晶胞与金刚石晶胞微粒排列方式相似,
故答案为:8;水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成4个氢键.
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:8;水中的O和金刚石中的C都是sp3杂化,且水分子间的氢键具有方向性,每个水分子可与相邻的4个水分子形成4个氢键.
点评:本题考查物质结构和性质,考查考生对晶体结构和原子的杂化方式的理解能力,难度不大.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列说法错误的是( )
| A、原子最外层电子数为2的元素一定处于元素周期表第ⅡA族 |
| B、L层电子数为奇数的所有元素所在族的序数与该元素原子的L层电子数相同 |
| C、短周期主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为1或2 |
| D、M层电子数为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相同 |
用含有少量镁的铝片制取纯净的Al(OH)3,可能有的步骤为:①加盐酸溶解;②加过量苛性钠溶液;③过滤;④通入过量CO2;⑤加过量纯碱溶液,实验操作最合理的组合及顺序是( )
| A、①⑤④③ | B、②③④③ |
| C、②③⑤③ | D、①⑤③ |
辛烷C8H18在一定条件下受热裂化,生成CH4、C2H6、C2H4、C3H6、C4H8五者的混合气体,此混合气体的平均相对分子质量可能为( )
| A、14 | B、38 | C、57 | D、无定值 |
以惰性电极电解某溶液,发现两极只有氢气和氧气生成.则电解一段时间后.下列有关该溶液(温度不变)的说法中.
(1)该溶液的pH可能增大(2)该溶液的pH可能减小
(3)该溶液的pH可能不变(4)该溶液的浓度可能不变
(5)该溶液的浓度可能增大(6)该溶液的浓度可能减小.
正确的是( )
(1)该溶液的pH可能增大(2)该溶液的pH可能减小
(3)该溶液的pH可能不变(4)该溶液的浓度可能不变
(5)该溶液的浓度可能增大(6)该溶液的浓度可能减小.
正确的是( )
| A、只有(1)(2)(3)(6) |
| B、只有(1)(2)(3)(4) |
| C、只有(1)(2)(3)(5) |
| D、只有(1)(2)(3)(4)(5) |
用NA 表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、98克H2SO4和H3PO4 含有的氧原子数均为4NA. |
| B、1L1mol?L-1 的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6LNO2 溶解于足量的水中得到的硝酸溶液,溶液中NO3-数目为NA |
| D、32克铜发生氧化还原反应,一定失去NA 个电子 |
常温下,下列有关叙述正确的是( )
| A、在Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B、在pH=8的NaB溶液中:c(Na+)-c(B-)=0.99×10-6 mol?L-1 |
| C、pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中:c(NH4+)大小顺序①=②>③ |
| D、向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V总≥20mL |

