题目内容
下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①Na+H2O ②NO2+H2O ③CO2+H2O ④Na2O+H2O ⑤Cl2+H2O.
①Na+H2O ②NO2+H2O ③CO2+H2O ④Na2O+H2O ⑤Cl2+H2O.
| A、①③ | B、③④ | C、③⑤ | D、②⑤ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:有元素化合价变化的反应属于氧化还原反应,在氧化还原反应中水中H、O元素的化合价都不发生变化,则水既不作氧化剂又不作还原剂.
解答:
解:①Na和H2O的反应中Na元素的化合价升高,氢元素的化合价降低,则属于氧化还原反应,且水作氧化剂,故①错误;
②NO2和H2O的反应中,N元素的化合价既升高又降低,则属于氧化还原反应,且水既不作氧化剂又不作还原剂,故②正确;
③CO2+H2O反应生成碳酸,元素化合价没有发生变化,不是氧化还原反应,故③错误;
④Na2O和H2O的反应中,各元素的化合价都没有变化,则不属于氧化还原反应,故④错误;
⑤Cl2和H2O的反应中,Cl元素的化合价既升高又降低,则属于氧化还原反应,且水既不作氧化剂又不作还原剂,故⑤正确;
故选D.
②NO2和H2O的反应中,N元素的化合价既升高又降低,则属于氧化还原反应,且水既不作氧化剂又不作还原剂,故②正确;
③CO2+H2O反应生成碳酸,元素化合价没有发生变化,不是氧化还原反应,故③错误;
④Na2O和H2O的反应中,各元素的化合价都没有变化,则不属于氧化还原反应,故④错误;
⑤Cl2和H2O的反应中,Cl元素的化合价既升高又降低,则属于氧化还原反应,且水既不作氧化剂又不作还原剂,故⑤正确;
故选D.
点评:本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意把握反应中元素的化合价,为解答本题的关键,难度不大,注重基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,将Na2CO3和NaHCO3的混合物[设
=a,0<a≤3]溶于水得到稀溶液,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| n(Na2CO3) |
| n(NaHCO3) |
| A、若a=1,则:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、若a=2,则:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时:c(Na+)+c(H+)=c(HCO32-)+2c(CO32-)+c(OH-) |
| D、若满足:3c(H+)+2c(HCO3-)+5c(H2CO3)=3c(OH-)+c(CO32-),则可确定a=3 |
下列化学方程式或离子方程式正确的是( )
| A、常温下,将铁片置于浓硝酸中:Fe+6H++3NO3-═Fe3++3NO2↑+3H2O |
| B、向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O |
| C、向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ |
| D、向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
据下列反应判断有关物质的氧化性顺序正确的是( )
①F2+2NaCl(熔融)═2NaF+Cl2 ②Cl2+2NaBr═2NaCl+Br2 ③Br2+2NaI═2NaBr+I2.
①F2+2NaCl(熔融)═2NaF+Cl2 ②Cl2+2NaBr═2NaCl+Br2 ③Br2+2NaI═2NaBr+I2.
| A、F2>Br2>I2>Cl2 |
| B、I2>Br2>Cl2>F2 |
| C、F2>Cl2>Br2>I2 |
| D、NaI>NaBr>NaCl>NaF |
下列实验现象与氧化还原反应有关的是( )
| A、碳酸钠中加入CaCl2溶液产生白色沉淀物 |
| B、硫酸铜溶液中插入铁片,铁片上出现红色沉淀物 |
| C、石灰石溶于盐酸并产生气泡 |
| D、氯化铵溶液中加入氢氧化钠溶液并加热,产生的气体使湿润的红石蕊试纸变蓝 |
测得室温下0.1mol?L-1的某酸HA溶液的PH=3,下列叙述错误的是( )
| A、HA是弱酸 |
| B、若升高温度,溶液的PH增大 |
| C、此酸的电离平衡常数约为10-5 |
| D、由HA电离出的c(H+)约为水电离出的c(H+)的108倍 |

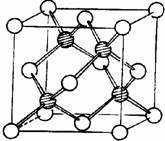 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似.每个冰晶胞平均占有