题目内容
4.下列说法中正确的是( )| A. | 1molN2和1molCO所含的分子数都是NA | |
| B. | 1molH2和1molCO2所含的原子数都是NA | |
| C. | 1molCO和1molCO2所含的氧原子数都是NA | |
| D. | 1molH2SO4和1molH3PO4所含的原子数都是4NA |
分析 A、分子个数N=nNA;
B、氢气为双原子分子,而二氧化碳为三原子分子;
C、CO中含一个氧原子,而二氧化碳中含2个氧原子;
D、硫酸中含7个原子,磷酸中含8个原子.
解答 解:A、由于分子个数N=nNA,故当物质的量相等时,分子个数也相等,则1mol氮气和1molCO中均含NA个分子,故A正确;
B、氢气为双原子分子,而二氧化碳为三原子分子,故1mol氢气中含2NA个原子,1mol二氧化碳中含3NA个原子,故B错误;
C、CO中含一个氧原子,而二氧化碳中含2个氧原子,故1molCO和1mol二氧化碳中含有的氧原子个数分别为NA个和2NA个,故C错误;
D、硫酸中含7个原子,磷酸中含8个原子,故1mol硫酸中含7NA个氧原子,1mol磷酸中含8NA个原子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.化学深入我们生活,下列说法正确的是( )
| A. | PX 项目的主要产品对二甲苯属于饱和烃 | |
| B. | 食用花生油和鸡蛋清都能发生水解反应 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 保护加酶洗衣粉的洗涤效果,应用沸水溶解洗衣粉 |
19. 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示)
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4为正四面体形,H2O为V形.
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能:MgF2>NaF,故MgF2的熔点比NaF高.
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
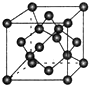
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$cm(用代数式表示).
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.(1)Y原子核外共有7种不同运动状态的电子,基态T原子有7种不同能级的电子.
(2)X、Y、Z的第一电离能由小到大的顺序为C<O<N(用元素符号表示)
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为sp杂化.
(4)Z与R能形成化合物甲,1mol甲中含4mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为SiF4为正四面体形,H2O为V形.
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低,Mg2+的半径比Na+的半径小,电荷数高,晶格能:MgF2>NaF,故MgF2的熔点比NaF高.
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
(7)X单质的晶胞如图所示,一个X晶胞中有8个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为$\frac{\sqrt{2}×\root{3}{\frac{12}{ρ{N}_{A}}}}{2sin\frac{109°28′}{2}}$cm(用代数式表示).
16.下列化学用语只能用来表示一种微粒的是( )
| A. | C3H8 | B. |  | C. | 二氯乙烷 | D. |  |
13.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 向少量燃尽火柴头的浸泡液中滴加稀硫酸,AgNO3 | 验证火柴头含有氯元素 |
| B | 向两支装有等体积,等浓度的H2O2溶液试管中分别加入1mol等浓度的FeCl3溶液、CuSO4溶液 | 催化效果:Fe3+>Cu2+ |
| C | 向待测溶液中加NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝的气体 | 证明原溶液中含有NH4+ |
| D | 向等浓度的NaCl、KI混合液中逐滴加入AgNO3溶液先出现黄色沉淀 | K(sp),AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
14.一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后回复到原来的温度,下列说法正确的是( )
| A. | 溶液的pH增大,有O2放出 | B. | 溶质质量分数增大,有O2放出 | ||
| C. | 溶液c(Na+)增大,有O2放出 | D. | 溶液n(Na+)减小,有O2放出 |

 .
. .
. (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为HCHO、CH3COCHO,它们物质的量之比是2:1.