题目内容
14.一定温度下,向饱和烧碱溶液中放入少量过氧化钠,反应后回复到原来的温度,下列说法正确的是( )| A. | 溶液的pH增大,有O2放出 | B. | 溶质质量分数增大,有O2放出 | ||
| C. | 溶液c(Na+)增大,有O2放出 | D. | 溶液n(Na+)减小,有O2放出 |
分析 过氧化钠与水反应生成NaOH和O2,消耗水,溶液有NaOH晶体析出,反应后仍为饱和溶液,温度一定,氢氧化钠溶液浓度不变,由于溶剂的质量减少,则饱和溶液中的溶质的物质的量减小,据此分析.
解答 解:过氧化钠与水反应生成NaOH和氧气,该反应为2Na2O2+2H2O=4NaOH+O2↑,因为已经饱和,所以不会再溶解,浓度不变,但由于水的减少,水中Na+、OH-的数目减少.
A.有O2放出,原饱和溶液有晶体析出,剩余溶液还是饱和溶液,温度不变时,溶液中离子的浓度不变,溶液中OH-浓度不变,溶液中H+浓度也不变,即溶液pH值不变,故A错误;
B.原饱和溶液有晶体析出,剩余溶液还是饱和溶液,温度不变时,溶液中离子的浓度不变,溶质质量分数不变,有O2放出,故B错误;
C.溶液中Na+浓度不变,有O2放出,故C错误;
D.浓度不变,但由于水的减少,水中Na+、OH-的数目减少,溶液n(Na+)减小,有O2放出,故D正确;
故选D.
点评 本题考查钠的重要化合物,侧重于化学知识的综合应用的考查,注意把握饱和溶液的性质,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
4.下列说法中正确的是( )
| A. | 1molN2和1molCO所含的分子数都是NA | |
| B. | 1molH2和1molCO2所含的原子数都是NA | |
| C. | 1molCO和1molCO2所含的氧原子数都是NA | |
| D. | 1molH2SO4和1molH3PO4所含的原子数都是4NA |
5.下列实验方案中,不能达到实验目的是( )
| 编号 | 实验内容 | 实验目的 |
| A | 分别将一小粒钠投入水与无水乙醇中,钠与水反应更剧烈 | 证明羟基氢活泼性: H2O>C2H5OH |
| B | 向滴有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液,溶液褪色 | 证明溴乙烷发生消去反应有乙烯生成 |
| D | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
9.下列能用勒夏特列原理解释的是( )
| A. | 铁在潮湿的空气中易腐蚀 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | 往往需要在催化剂条件下SO2氧化成SO3 | |
| D. | H2、I2、HI平衡混和气加压后颜色变深 |
19.今年“世界水日”主题“关注水质、抓住机遇、应对挑战”,下列与主题不符的是( )
| A. | 上海属“水质性缺水”,保护水资源刻不容缓 | |
| B. | 提倡节水产业,加强废水处理 | |
| C. | 只喝桶装水或功能性饮料以保证饮用水质量 | |
| D. | 用再生水灌溉城市绿地 |
6.下列离子方程式书写正确的是( )
| A. | 碳酸钙溶于稀硝酸:CO32-+2H+→CO2↑+H2O | |
| B. | 氯化铜溶液中加入NaHS溶液:Cu2++HS-=CuS↓+H+ | |
| C. | 碳酸钠溶液中通入少量二氧化碳:CO32-+CO2+H2O=2HCO3- | |
| D. | 硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-→NH3↑+H2O |
12. 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
(1)测定蓝矾属于晶体的物理方法是X-射线衍射.其中SO42-中S原子的轨道杂化形式是sp3;H2O的空间构型是V形.
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
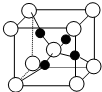
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
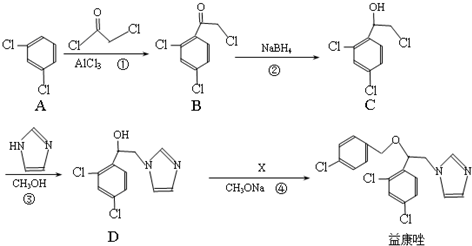
 .
. .
.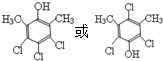 .
. 和
和 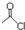 为原料制备
为原料制备 的合成路线流程图(乙醇和无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(乙醇和无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.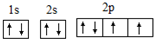 ;氧元素原子核外有3种不同能级的电子;
;氧元素原子核外有3种不同能级的电子;