题目内容
18.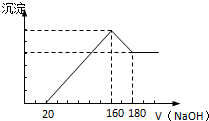 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为2mol/L的NaOH溶液,生成的沉淀与加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)请回答下列有关问题:
(1)合金中Al的质量为1.08g.
(2)所用盐酸的物质的量浓度为c(HCl)=3.2mol•L-1.
分析 (1)从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×2mol/L=0.04mol,由元素守恒可知n(Al)=n[Al(OH)3再利用m=nM计算Al的质量.
(2)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=$\frac{n}{V}$计算盐酸的物质的量浓度.
解答 解:(1)由图可知,从加入20mL氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,该阶段消耗氢氧化钠140mL,从加入氢氧化钠溶液160mL~180mL溶解氢氧化铝,该阶段发生反应Al(OH)3+NaOH=NaAlO2+2H2O,所以n[Al(OH)3]=(0.18L-0.16L)×2mol/L=0.04mol,由元素守恒可知n(Al)=n[Al(OH)3]=0.04mol,所以Al的质量为0.04mol×27g/mol=1.08g,
故答案为:1.08;
(2)加入氢氧化钠溶液为160mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.16L×2mol/L=0.32mol,根据氯元素守恒n(HCl)=0.32mol,故盐酸的物质的量浓度为$\frac{0.32mol}{0.1L}$=3.2mol/L.
故答案为:3.2.
点评 本题考查镁铝化合物性质、混合物的计算,以图象题的形式考查,题目难度中等,分析图象各阶段的发生的反应是解题关键,再利用守恒计算.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | “化学纯”是指这种硫酸只含H2SO4和H2O分子 | |
| D. | 配制460mL2.3mol•L-1的稀硫酸需量取该硫酸62.5 mL |
| A. | 甲烷与乙烯共1 mol,完全燃烧后生成2mol H2O | |
| B. | 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种 | |
| C. | 乙烯可以用作生产食品包装材料的原料 | |
| D. | 乙烷室温下能与浓盐酸发生取代反应 |
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 取一定量的废水样品,经测定其中有n(Cu2+)=0.01mol,n(Fe2+)+n(Fe3+)=0.01mol,则该水样中0mol≤n(Cl-)≤0.05mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4mL恰好完全反应,然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.16g,则废水中c(Fe3+)=0.01 mol•L-1 |
| A. | 稀硫酸 | B. | 稀硝酸 | C. | NaOH溶液 | D. | 硫酸铜溶液 |
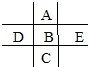 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .A单质的电子式为
.A单质的电子式为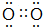 .
.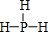 .
.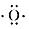 ;D原子的结构示意图
;D原子的结构示意图 .
. ,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.
,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.