题目内容
4.BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )| A. | c (Ba2+)=c(SO42-)=(Ksp)${\;}^{\frac{1}{2}}$ | B. | c(Ba2+)•c(SO42-)>Ksp,c(Ba2+)=c(SO42-) | ||
| C. | c(Ba2+)•c(SO42-)=Ksp,c(Ba2+)>c(SO42-) | D. | c(Ba2+)•c(SO42-)≠Ksp,c(Ba2+)<c(SO42-) |
分析 在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,存在沉淀溶解平衡,BaSO4(s)?Ba2++SO42-;若以Ksp表示BaSO4的溶度积,则Ksp=c(Ba2+)•c(SO42-),饱和溶液中c(Ba2+)=c(SO42-),加入氯化钡溶液增大钡离子浓度,沉淀溶解平衡向生成沉淀的方向进行,硫酸根离子浓度减小,溶度积常数随温度变化,不随浓度改变.
解答 解:A、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,故A错误;
B、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,温度不变,溶液中的溶度积常数不变,故B错误;
C、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,钡离子浓度大于硫酸根离子浓度,溶液中的溶度积常数不变,故C正确;
D、溶度积常数是随温度变化不随浓度改变,最后溶液中的溶度积常数不变,钡离子浓度大于硫酸根离子浓度,故D错误;故选C.
点评 本题考查了沉淀溶解平衡的建立和影响因素判断,注意溶度积随温度变化是分析解题关键,题目较简单.

练习册系列答案
相关题目
14.某有机物(分子式为C7Hx)完全燃烧时生成等物质的量的CO2与H2O,且能使溴的CCl4溶液褪色,若其结构中只含有两个-CH3,则该物质的结构(不考虑立体异构)最多有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 11种 |
12.将下列离子方程式改写成化学方程式,正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═H2O+CO2↑ BaCO3+2HCl═BaCl2+H2O+CO2↑ | |
| C. | Ca2++CO32-═CaCO3↓ Ca(OH)2+K2CO3═CaCO3↓+2KOH | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
13.氨基呈碱性,氨基酸呈两性,把甘氨酸(氨基乙酸)放入一定pH的溶液中,所得溶液中不能同时大量存在的微粒是( )
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
①H2NCH2COOH ②H3N+-CH2COOH ③H2NCH2COO- ④H3N+-CH2COO-.
| A. | ①与② | B. | ①与③ | C. | ②与③ | D. | ②与④ |
18.标准状况下,气态分子断开1mol化学键所需的能量称为键能.已知H-H,H-O,和O═O键的键能分别为436KJ/mol,463KJ/mol,495KJ/mol,下列热化学方程式正确的是( )
| A. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=-485KJ/mol | B. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+485KJ/mol | ||
| C. | 2 H2(g)+O2(g)═2 H2O(g)△H=+485KJ/mol | D. | 2 H2(g)+O2(g)═2 H2O(g)△H=-485KJ/mol |
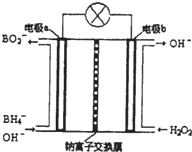 硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题:
硼氢化钠(NaBH4)是有机合成中的重要还原剂,最新研究发现,以NaBH4和H2O2为原料,NaOH溶液作电解质溶液,可以设计成全液流电池,其工作原理如图所示,假设电池工作前左右两槽溶液的体积各为1L,回答下列问题: