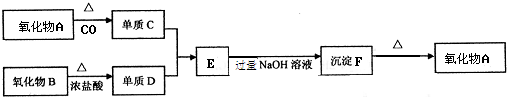
题目内容
20.下列说法中正确的是( )| A. | 升高温度,可使单位体积内活化分子数增多,反应速率加快 | |
| B. | 已知:C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3 kJ/mol,△S=+133.7 kJ/mol则该反应在低温下能自发进行 | |
| C. | 将FeCl3的水溶液加热蒸干可得到FeCl3固体 | |
| D. | 使用催化剂可降低反应的△H和反应的活化能,从而提高化学反应速率 |
分析 A.升高温度,可增大活化分子百分数;
B.如反应能自发进行,应满足△H-T•△S<0;
C.FeCl3加热易发生水解;
D.加入催化剂,反应热不变.
解答 解:A.升高温度,可增大活化分子百分数,则单位体积内活化分子数增多,反应速率加快,故A正确;
B.如反应能自发进行,应满足△H-T•△S<0,△H=+131.3 kJ/mol,△S=+133.7 kJ/mol,应在较高的温度下进行,故B错误;
C.FeCl3加热易发生水解,如加热蒸干,得到氢氧化铁或氧化铁固体,故C错误;
D.加入催化剂,反应热不变,故D错误.
故选A.
点评 本题考查较为综合,涉及反应速率的影响,平衡移动、盐类水解等知识,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列与实验相关的叙述正确的是( )
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 | |
| C. | 从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | |
| D. | 取少量溶液依次加入BaCI2溶液和稀盐酸产生白色沉淀,则原溶液一定含有SO42- |
8.下列变化中,不需要破坏化学键的是( )
| A. | 干冰气化 | B. | 食盐熔化 | C. | 氯化钙溶于水 | D. | 小苏打受热分解 |
5.某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验.已知:c(H2SO4)=4.5mol•L-1,反应均需要搅拌60min.
(1)实验①和②的目的是其它条件不变,温度对稀硫酸溶解铝粉量的影响.
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | 20 | 不加 | 20 | 20 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol•L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是反应60min后剩余铝粉的质量.
(2)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2=20℃,V2=15 mL.
(3)研究表明,在相同条件下加入少量CuSO4有利于Al的溶解.原因是少量的Cu与Al构成原电池,使反应速率加快.
12.已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH,下列说法正确的是( )
| A. | 浓度均为0.1 mol•L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强 | |
| B. | 0.1 mol•L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小 | |
| C. | NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒 | |
| D. | NaF溶液中加入少量NaOH固体,溶液中c(F-)变小 |
9.下列叙述正确的是( )
| A. | 元素的单质不能通过氧化含该元素的化合物制得 | |
| B. | 得电子越多的氧化剂,其氧化性就越强 | |
| C. | 阳离子只能得到电子被还原,只能作氧化剂 | |
| D. | 含有最高价元素的化合物不一定具有强的氧化性 |