题目内容
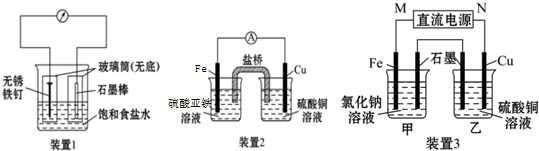
2.以标准的盐酸溶液滴定未知的氢氧化钠为例,判断以下操作所引起的误差(填“偏大”、“偏小”或“不变”)(1)标准液在刻度线以上,未予调整;偏低
(2)滴定前仰视,滴定后俯视(标准液);偏低
(3)碱式滴定管(待测液),或移液管里有水珠未经润洗,直接注入待测液偏低
(4)滴定到指示剂颜色刚变化,就认为到了滴定终点.偏低
(5)锥形瓶用蒸馏水冲洗后,不经干燥便直接盛待测溶液无影响
(6)滴定接近终点时,用少量蒸馏水冲洗瓶内壁.无影响.
分析 根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$,结合错误操作对标准溶液体积的影响分析.
解答 解:(1)标准液在“0”刻度线以上,未予调整就开始滴定,造成V(标准)偏小,根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$,可知c(标准)偏小,故答案为:偏低;
(2)读取标准液读数时,滴前仰视,滴定到终点后俯视,造成V(标准)偏小,根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$可知c(待测)偏小,故答案为:偏低;
(3)未润洗,待测液的浓度偏小,物质的量偏小,造成V(标准)偏小,根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$,可知c(标准)偏小,故答案为:偏低;
(4)指示剂局部的颜色有变化就停止滴定,反应还没有结束,导致消耗的标准液体积偏小,测定结果偏低,故答案为:偏低;
(5)锥形瓶不经干燥便直接盛待测溶液,不影响待测物的总物质的量,滴定是不影响消耗的标准液的体积,故答案为:无影响;
(6)滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁,所取待测液的量不变,V(标准)不变,故答案为:无影响.
点评 本题主要考查了中和滴定操作、误差分析,难度不大,注意把握中和滴定实验的误差分析方法.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
17.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B. Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
10.某溶液中含有Na+、Fe2+、Fe3+、Al3+四种离子,若向溶液中先滴加过量的NaOH溶液,然后再滴加过量的稀盐酸,则溶液中离子数目保持不变的是( )
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
17.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH试纸呈红色的溶液:Na+、K+、Fe3+、NO3- |
7.下列事实不能用勒夏特列原理解释的是( )
| A. | 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅 | |
| B. | 增大压强可加快SO2转化为SO3的速率 | |
| C. | 黄绿色的氯水光照后颜色变浅 | |
| D. | 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
14.下列物质命名正确的是( )
| A. | 1,3-二甲基丁烷 | B. | 2,3-二甲基-2-乙基己烷 | ||
| C. | 2,3-二甲基-4-乙基戊烷 | D. | 2,3,5-三甲基己烷 |
11.甲、乙、丙三种物质之间能通过一步反应实现转化关系:甲?乙?丙,则甲、丙不可能是( )
| A. | NO HNO3 | B. | CH2=CH2 CH3CHO | C. | Fe FeCL3 | D. | Si H2SiO3 |
12.有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
| A. | 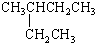 2-乙基丁烷 | B. | CH3CHBr2二溴乙烷 | ||
| C. |  2-甲基丁烯 | D. | 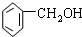 苯甲醇 |