题目内容
5.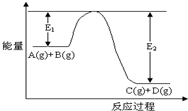 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题(1)C(g)+D(g)?A(g)+B(g)是放热反应(填“吸热”“放热”);
(2)当反应达到平衡时,降低温度,B的转化率增大(填“增大”“减小”“不变”).
(3)反应体系中加入A(g)对反应热是否有影响?无
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1减小,E2减小(填“增大”“减小”“不变”)
分析 (1)根据图象中反应物总能量和生成物总能量的关系判断反应热;
(2)根据温度对化学平衡的影响来分析,降低温度平衡向放热反应方向进行;
(3)反应热和反应物、生成物的能量有关和变化过程无关;
(4)加入催化剂能降低物质的活化能.
解答 解:(1)由图象可以看出反应物总能量大于生成物的总能量,则该反应的正反应为放热反应,
故答案为:放热;
(2)当反应达到平衡时,该反应正反应为放热反应,降低温度使平衡向正反应方向移动,B的转化率增大,
故答案为:增大;
(3)反应热和反应物、生成物的能量有关和变化过程无关,反应体系中加入A(g)对反应热无影响,
故答案为:无;
(4)加入催化剂能降低反应物质的活化能,正逆反应的活化能则E1和E2都减小,
故答案为:减小;减小.
点评 本题考查反应热的判断,影响化学反应速率和平衡的因素,题目难度不大,根据所学知识即可完成,注意反应热的实质理解.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )

| A. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| B. | 该硫酸试剂的物质的量浓度为18.4mol/L | |
| C. | 50mL该H2SO4中加入足量的铜片加热,被还原的H2SO4的物质的量为0.46mol | |
| D. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H23.36L |
1.下列说法或表示方法正确的是( )
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩锅 | |
| C. | 图是某一种物质的结构简式是  则该物质是一种烃 则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为 |
5.X、Y、Z三种元素原子序数依次增大,X与Z同主族,Y与Z同周期,Z的单质通常为黄绿色气体,Z与Y能形成YA型化合物,下列说法正确的是( )
| A. | 在元素周期表中,Y所在族的元素都是活泼金属元素 | |
| B. | 37Z原子核电子数为20 | |
| C. | X与Y能形成YX型化合物 | |
| D. | 在常温下,Z的单质与氢气一定能大量共存 |
10.某溶液中含有Na+、Fe2+、Fe3+、Al3+四种离子,若向溶液中先滴加过量的NaOH溶液,然后再滴加过量的稀盐酸,则溶液中离子数目保持不变的是( )
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
17.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Cu2+、H+、Cl-、SiO32- | |
| B. | NaAlO2溶液:NH4+、H+、Cl-、CO32- | |
| C. | NaHCO3溶液:K+、Al3+、SO42-、NO3- | |
| D. | 能使pH试纸呈红色的溶液:Na+、K+、Fe3+、NO3- |
14.下列物质命名正确的是( )
| A. | 1,3-二甲基丁烷 | B. | 2,3-二甲基-2-乙基己烷 | ||
| C. | 2,3-二甲基-4-乙基戊烷 | D. | 2,3,5-三甲基己烷 |