题目内容
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
(1)O2->Na+>Al3+ HNO3>H2CO3>H2SiO3 HCl>H2S>SiH4 (3分)
(2)HClO4 (1分) OH-+H+ = H2O (1分)MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O (2分)
MnCl2 + Cl2 ↑+ 2H2O (2分)
(3)Al(OH)3+OH- = AlO2-+2H2O (2分)
(4)离子键和非极性共价键 (2分) Na2O2+SO2=Na2SO4(2分)
解析试题分析:根据各元素在元素周期表中的位置可推知:a为H,b为C,c为N,d为O,e为Na,f为Al,g为Si,h为S,i为Cl。
(1)d、e、f的离子为O2?、Na+、Al3+,电子排布相同,原子序数越大,离子半径越小,所以O2->Na+>Al3+;b、c、g的最高价含氧酸分别为H2CO3、HNO3、H2SiO3,根据元素周期律酸性:HNO3>H2CO3>H2SiO3;a与g、h、i形成的简单化合物分别为SiH4、H2S、HCl,稳定性由强到弱的顺序为:HCl>H2S>SiH4。
(2)i元素的最高价氧化物对应的水化物为HClO4;e的最高价氧化物对应水化物为NaOH,反应的离子方程式为:OH-+H+ = H2O;实验室由MnO2与浓盐酸反应制取Cl2,化学方程式为:MnO2 + 4HCl(浓)  MnCl2 + Cl2 ↑+ 2H2O。
MnCl2 + Cl2 ↑+ 2H2O。
(3)呈两性的氢氧化物是Al(OH)3,溶于强碱的离子方程式为:Al(OH)3+OH- = AlO2-+2H2O。
(4)e与d能形成一种淡黄色的化合物为Na2O2,含有离子键和非极性共价键;h的低价态氧化物为SO2,Na2O2能把SO2氧化为Na2SO4,化学方程式为:Na2O2+SO2=Na2SO4。
考点:本题考查元素的推断、元素周期律和元素周期表、化学方程式和;离子方程式的书写。

回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中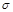 键与 键与 数目比为1:2 数目比为1:2 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (填离子符号)。
(3)H?X与H?Y两种共价键中,键的极性较强的是 ,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是 (填元素符号);Y的常见氢化物易液化的主要原因是 。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是 。
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为____(填化学式)。
(3)⑤和⑨形成化合物的晶体类型为__________。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式__________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为 ,写出X溶液与小苏打反应的化学方程式为_______________。


