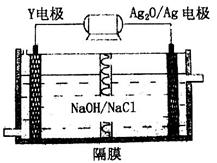
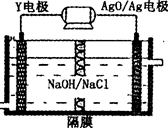
题目内容
以下是一些元素的信息,其中有一种元素不在短周期。
| 元素A | 元素B | 元素C | 元素X | 元素Y |
| 单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中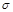 键与 键与 数目比为1:2 数目比为1:2 |
(1)写出A元素基态原子的核外电子排布式 。
(2)B、C、X的简单离子半径由大到小的顺序为 (填离子符号)。
(3)H?X与H?Y两种共价键中,键的极性较强的是 ,键长较长的是
(X、Y用元素符号表示)。
(4)X、Y二种元素第一电离能从大到小的顺序是 (填元素符号);Y的常见氢化物易液化的主要原因是 。
(5)X常见氢化物的蒸气与A 的粉末在高温条件下充分反应,生成一种黑色磁性固态化合物和一种气体单质,此反应的化学方程式是 。
(1)1s22s22p63s23p63d64s2 或[Ar] 3d64s2(2分)
(2)Cl->O2->Na+(2分)
(3)H?O H?N(各1分)
(4)N>O NH3分子间存在氢键(各1分)
(5)3Fe+4H2O(g) Fe3O4+4H2(2分)
Fe3O4+4H2(2分)
解析试题分析:ABCXY分别为Fe、Cl、Na、O、N。(1)Cl-电子层数为3层,O2-、Na+的电子层数为2层,电子层数多半径大,电子层数相同质子数多半径小,故有Cl->O2->Na+;(3)氧元素的非金属性强于氮元素,故氧氢键极性强,氧原子半径小于氮原子,故氧氢键键长短;(4)氮元素最外层电子为半满的相对稳定结构,能量较低,第一电离能大于相邻元素原子;氨气中存在分子间氢键,导致其熔沸点较高。
考点:考查物质结构与元素周期律有关问题。

练习册系列答案
相关题目
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。