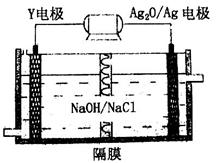
题目内容
回答以下关于第三周期元素及其化合物的问题。
(1)下列能用于判断氧和氟非金属性强弱的是 (选填编号)。
A.气态氢化物的稳定性 B.最高价氧化物对应水化物的酸性
C.单质与氢气反应的难易 D.单质与同浓度酸发生反应的快慢
(2)Be和Al具有相似的化学性质,写出BeCl2水解反应的化学方程式
(3)常温下,不能与铝单质发生反应的是_________(填序号)
A.CuSO4溶液 B.Fe2O3 C.浓硫酸 D.NaOH E.Na2CO3固体
(4)相同压强下,部分元素氟化物的熔点见下表:
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/℃ | 1266 | 1534 | 183 |
试解释上表中氟化物熔点差异的原因: 。SiF4分子的空间构型为 ,SiF4中Si—F键间的键角 。(选填“相等”、“不相等”或“无法判断”)
(5)Cl2合成有机物时会产生副产物HC1。4HCl+O2
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。该反应平衡常数的表达式K= ;若反应容器的容积为2L,8min后达到平衡,测得容器内物质由2.5mol减少至2.25mol,则HCl的平均反应速率为 mol/L? min。
(1)AC
(2)BeCl2+2H2O  Be(OH)2+2HCl
Be(OH)2+2HCl
(3)B、E
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。(2分)
正四面体(1分),相等(1分)
(5)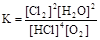 (1分) 0.0625mol/L? min (1分)
(1分) 0.0625mol/L? min (1分)
解析试题分析:(1)判断氧和氟非金属性强弱可依据气态氢化物的稳定性,由于氟没有最高价氧化物对应水化物,故不能通过酸性比较,还可通过单质与氢气反应的难易判断,非金属单质一般不会与酸发生反应,故不可。选AC。
(2)BeCl2是一种强酸弱碱盐,其水解反应的化学方程式BeCl2+2H2O  Be(OH)2+2HCl 。
Be(OH)2+2HCl 。
(3)A.铝单质与CuSO4溶液发生置换反应。B.Fe2O3 不能发生。 C.浓硫酸发生钝化。 D.NaOH与铝生成偏铝酸钠和氢气。 E.Na2CO3固体与铝不发生反应。故常温下,不能与发生反应的是B、E。
(4)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高。SiF4发生SP3杂货,分子的空间构型为正四面体,SiF4中Si—F键间的键角相等。
(5)反应4HCl+O2  2Cl2+2H2O,的平衡常数的表达式
2Cl2+2H2O,的平衡常数的表达式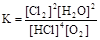 ;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L? min。
;则HCl的平均反应速率为(2.5mol-2.25mol)/(2L*8min)= 0.0625mol/L? min。
考点:本题考查元素非金属性强弱判断,晶体熔沸点判断,化学反应速率的计算等。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案(本题共12分)
我国钾长石(KAlSi3O8)的资源比较丰富。工业上可用食盐和钾长石在一定条件下制备氯化钾:NaCl (l) +KAlSi3O8 (s)  KCl (l)+NaAlSi3O8 (s)。
KCl (l)+NaAlSi3O8 (s)。
完成下列填空:
(1)硅原子的最外层电子占据了 个轨道,有 种能量。
(2)氯化钠的熔点比氯化钾的 (填“高”或“低”),原因是 。
(3)把反应中涉及到的六种元素的原子半径按从小到大的顺序排列 。
(4)参与上述反应且位于同一周期的几种元素中,有一种元素的最高价氧化物的水化物和其余元素的最高价氧化物的水化物均能发生反应,这种元素是 。
(5)为研究上述反应中钾元素的熔出率(液体中钾元素的质量占全部钾元素质量的百分率)与温度的关系,进行实验(氯化钠与钾长石投料的质量比为2:1),获得如下数据:
| 时间(h) 钾元素 温度 熔出率 | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
①分析数据可以得出,该制备氯化钾的反应是 (填“放热”或“吸热”)反应。
②计算890℃时,氯化钠的平衡转化率 。(式量:KAlSi3O8–278 NaAlSi3O8 –262)
③950℃时,提高熔出钾的速率可以采取的措施是 (写出两种)。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。