题目内容
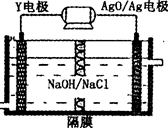
W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。
(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
| A.M、X、Z形成的单质熔沸点 M>X>Z |
| B.氢化物的热稳定性:W>X |
| C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同 |
| D.Z元素含氧酸的酸性一定强于Y元素的含氧酸 |
(4)X、Z与氢三种元素按1:2:2形成的五原子化合物属于_______分子(填 “极性” “非极性”)
(5)与Z同族的元素都能形成氢化物,其中水溶性最强的是______(填化学式)
(6)含有N元素的两种常见离子能发生双水解反应,试写出该离子方程式 ________________。
(1)第三周期第IVA族(1+1分);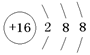 (2分)
(2分)
(2)B(2分)
(3)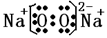 (2分)
(2分)
(4)极性(2分)
(5)HF(2分)
(6)Al3+ + 3AlO2﹣+ 6H2O = 4Al(OH)3↓(2分)
解析试题分析:(1)X单质是一种半导体材料,所以X为硅元素,Y的最外层电子数是最内层电子数的三倍又在硅元素后面,所以Y是硫元素;
(2)推断W为氧,M是钠,N是铝,X是硅,Y是硫,Z是氯,A、M、X、Z形成的单质熔沸点X>M>Z,错误;B、正确;C、硅和氧形成的是共价键,硅和氯形成的是离子键,错误;D、盐酸的酸性没有硫酸的强,错误。
(3)过氧化钠中既有共价键也有离子键;
(4)氯元素以离子键与别的元素结合,含有离子键,所以为极性分子;
(5)卤素氢化物的水溶性HF>HCl>HBr>HI;
(6)铝离子和偏铝酸根离子能发生双水解。
考点:常见的短周期元素。

练习册系列答案
相关题目
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。