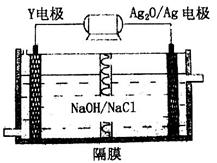
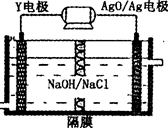
题目内容
周期表中前36号元素A、B、C、D、E、F、G、H,它们的原子序数依次增大,其中B、C、D为同一周期;E、F、G为同一周期;A和E、D和G分别为同一主族;A与B组成的化合物是一种温室气体;D元素原子的最外层电子数是次外层电子数的3倍;E是所在周期原子半径最大的元素(除稀有气体外);F元素的离子半径是同周期元素形成的简单离子中最小的;H元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
(1)E2D2物质中化学键的类型是__________________
(2)一定条件下,A2气体与C2气体充分反应可生成6.8 g的气体,放出18.44 kJ热量,则该反应的热化学方程式为:_________________________________________;生成物分子的空间构型为_________________,其中C的杂化方式为_______________。
(3)C和E组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是
。
(4)H的基态原子的电子排布式为__________________________已知H2+能与(2)中的生成物的水溶液形成配合物,请写出该配合物中阳离子的结构简式:_________________,在此配合物的水溶液中加入乙醇,现象是_______________________________________。
(5)将足量的GD2通入EDA溶液中所得溶液的离子浓度的大小顺序为:
(1)非极性共价键、离子键
(2)N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol 三角锥形 sp3杂化
2NH3(g);△H=-92.2kJ/mol 三角锥形 sp3杂化
(3)Na3N + 4H2O=3NaOH + NH3·H2O
(4)1s22s22p63s23p63d104s1 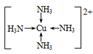 有深蓝色晶体析出
有深蓝色晶体析出
(5)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
解析试题分析:根据题干信息:A是氢、B是碳、C是氮、D是氧、E是钠、F是铝、G是硫、H是铜。
(1)Na2O2中含有非极性共价键和离子键。
(2)信息表示合成氨的热化学方程式。
(3)Na3N能与水反应生成两种的碱NaOH和NH3·H2O
(4)Cu离子可以与水形成四水合铜配合物。
(4)将足量的SO2通入NaOH溶液中所得溶液为NaHSO3溶液,HSO3- H++SO32-,HSO3-+H2O
H++SO32-,HSO3-+H2O H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
H2SO3+OH-,HSO3-电离的程度大于水解的程度,溶液呈酸性,溶液中各离子间的关系是:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
考点:本题考查了元素化合物的知识,有物质的推导,热化学方程式的书写。

下面是元素周期表的一部分,参照元素①-⑧在表中的位置,请用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | | ⑧ | |
(1)④、⑤、⑥的原子半径由大到小的顺序为(元素符号)________________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式)________ 。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:_______________。
(4)由②和④组成的化合物与⑤的同周期相邻主族元素的单质反应的化学方程式为:_______。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
(6)若用①②组成最简单的有机物作为燃料电池的原料,请写出在碱性介质中燃料电池负极的电极反应式: 。
(7)燃煤废气中的含有氮氧化物(NOx)、二氧化碳等气体,常用下列方法对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物。
如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) , △H=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) , △H=-1160 kJ·mol-1
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为 。
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| | Q | R | |
| T | | | W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。用化学用语回答下列问题。
| a | | | |||||||||||||||
| | | | | | | | | | | | | b | c | d | | | |
| e | | f | g | | h | i | | ||||||||||
| | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | |
(1)d、e、f的离子半径由大到小的顺序为
b、c、g的最高价含氧酸的酸性由强到弱的顺序为
a与g、h、i形成的简单化合物的稳定性由强到弱的顺序为
(2)i元素的最高价氧化物对应的水化物为 ,它与e的最高价氧化物对应水化物反应的离子方程式为 。
实验室制取i单质的化学方程式为
(3)呈两性的氢氧化物溶于强碱的离子方程式为
(4)e与d能形成一种淡黄色的化合物它的化学键类型为 它与h的低价态氧化物反应的化学方程式为 。
根据表中信息回答下列问题。
| 元素 | Si | P | S | Cl |
| 单质与氢气 反应的条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 光照或点燃时发生爆炸而化合 |
(1)S在元素周期表中的位置是 。
(2)根据表中信息可知,Si、P、S、Cl 四种元素的的非金属性依次增强。用原子结构解释原因:同周期元素电子层数相同,从左至右, ,原子半径逐渐减小,得电子能力逐渐增强。
(3)25℃时,以上四种元素的单质与氢气反应生成l mol气态氢化物的反应热如下:
a.+34.3 kJ·mol-1 b.+9.3 kJ·mol-1 c.?20.6 kJ·mol-1 d.?92.3 kJ·mol-1
请写出固态白磷(P4)与H2反应生成气态氢化物的热化学方程式 。
(4)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一。已知硒(Se)是人体必需的微量元素,其部分信息如图。
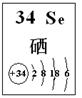
①下列有关说法正确的是 (填字母)。
a. 原子半径:Se>S>P b. 稳定性:H2Se>H2S
c. 因为酸性H2Se<HCl,所以非金属性Se<Cl
d. SeO2是酸性氧化物,能与烧碱溶液反应
②在下表中列出对H2SeO3各种不同化学性质的推测,举例并写出相应的化学方程式。
| 编号 | 性质推测 | 化学方程式 |
| 1 | 氧化性 | H2SeO3+4HI=Se↓+2I2+3H2O |
| 2 | | |
| 3 | | |