题目内容
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究.
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是 .
(2)pH≈4的原因是 (用化学用语表示).
(3)现象i中溶液由浅绿色逐渐变黄.某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色.证明原因①的实验方案是 ;证明原因②的实验方案是 .
(4)现象ⅱ中,溶液变为棕黄色.部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2.部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2.某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 .
| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液10mL,测溶液的pH | pH试纸变红(约为4) |
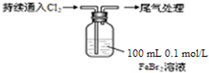 | ⅰ.开始通入100mL(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
(2)pH≈4的原因是
(3)现象i中溶液由浅绿色逐渐变黄.某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色.证明原因①的实验方案是
(4)现象ⅱ中,溶液变为棕黄色.部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2.部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2.某学生设计实验进行验证,请完成下列表格:
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | Cl2的氧化性强于Fe3+ | |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | |
| c | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
考点:氯、溴、碘的性质实验,铁及其化合物的性质实验
专题:实验设计题
分析:(1)浓盐酸与二氧化锰在加热条件下发生反应生成氯化锰、氯气和水;
(2)亚铁离子水解显酸性;
(3)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
(4)根据上述现象发生的原因可能是:Cl2先将Fe2+氧化生成Fe3+或Cl2先将Br-氧化生成Br2,故设计实验验证由浅绿色逐渐变黄色的原因,就是检验产生了Fe3+还是Br2;
由实验a可知,氧化性顺序Cl2>Fe3+
由实验b可知,氧化性顺序Br2>Fe3+
实验c由现象CCl4层由无色变为橙红色可知,应设计对比实验验证氧化性顺序 Cl2>Br2.
(2)亚铁离子水解显酸性;
(3)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
(4)根据上述现象发生的原因可能是:Cl2先将Fe2+氧化生成Fe3+或Cl2先将Br-氧化生成Br2,故设计实验验证由浅绿色逐渐变黄色的原因,就是检验产生了Fe3+还是Br2;
由实验a可知,氧化性顺序Cl2>Fe3+
由实验b可知,氧化性顺序Br2>Fe3+
实验c由现象CCl4层由无色变为橙红色可知,应设计对比实验验证氧化性顺序 Cl2>Br2.
解答:
解:(1)浓盐酸与二氧化锰在加热条件下发生反应生成氯化锰、氯气和水,反应的化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(2)亚铁离子为弱碱阳离子,水解显酸性,水解反应方程式为:Fe2++2H2O?Fe(OH)2+2H+,故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(3)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
故答案为:取5mL上述黄色溶液于试管中,向该溶液中加入KSCN溶液,溶液变为红色,说明原因①对,否则不成立;
取5mL上述黄色溶液于试管中,向其中滴加少量四氯化碳,震荡,若CCl4层呈橙红色,说明原因②对,否则不成立;
(4)由实验a可知,氧化性顺序Cl2>Fe3+,故看到溶液变红色;
由实验b可知,CCl4层没有明显变化,说明氧化性顺序Br2>Fe3+;
由现象CCl4层由无色变为橙红色可知,应设计对比实验验证氧化性顺序 Cl2>Br2,故操作为:取2mL溴化钠溶液于试管中,滴加少量氯水和少量CCl4,振荡静置;
由此得出结论,猜测①是正确的;故答案为:
由此实验得出的结论是 猜测①是正确的.
| ||
故答案为:MnO2+4HCl(浓)
| ||
(2)亚铁离子为弱碱阳离子,水解显酸性,水解反应方程式为:Fe2++2H2O?Fe(OH)2+2H+,故答案为:Fe2++2H2O?Fe(OH)2+2H+;
(3)原因①:Fe2+被C12氧化成Fe3+,向该溶液中加入KSCN溶液,溶液变为红色证明有三价铁生成;
原因②:Br-被C12氧化成Br2溶解在溶液中,通过溶液中加入适量四氯化碳,萃取出溴单质从而使CCl4层呈橙红色来证明有溴单质生成;
故答案为:取5mL上述黄色溶液于试管中,向该溶液中加入KSCN溶液,溶液变为红色,说明原因①对,否则不成立;
取5mL上述黄色溶液于试管中,向其中滴加少量四氯化碳,震荡,若CCl4层呈橙红色,说明原因②对,否则不成立;
(4)由实验a可知,氧化性顺序Cl2>Fe3+,故看到溶液变红色;
由实验b可知,CCl4层没有明显变化,说明氧化性顺序Br2>Fe3+;
由现象CCl4层由无色变为橙红色可知,应设计对比实验验证氧化性顺序 Cl2>Br2,故操作为:取2mL溴化钠溶液于试管中,滴加少量氯水和少量CCl4,振荡静置;
由此得出结论,猜测①是正确的;故答案为:
| 试管 | 操作 | 现象 | 结论 |
| a | 取2mL FeCl2溶液,滴加少量氯水、2滴KSCN溶液,振荡 | 溶液变红色 | Cl2的氧化性强于Fe3+ |
| b | 取2mL FeCl3溶液,滴加少量溴化钠溶液和少量CCl4,振荡 | CCl4层没有明显变化 | Br2>Fe3+ |
| c | 取2mL溴化钠溶液于试管中,滴加少量氯水和少量CCl4,振荡静置 | CCl4层由无色变为橙黄色 | Cl2的氧化性强于Br2 |
点评:本题考查了卤族元素化合物的知识,题目难度中等,熟悉溴离子、二价铁离子还原性强弱及离子或卤素单质的检验为解体关键.

练习册系列答案
相关题目
等体积、等浓度的NaCl、MgCl2、AlCl3溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则消耗AgNO3溶液的体积比为( )
| A、9:3:1 |
| B、1:2:3 |
| C、3:2:1 |
| D、6:3:21 |
能正确表示下列反应的离子方程式为( )
| A、碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O |
| B、二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ |
下列叙述不正确的是( )
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 |
| B、用平行光照射可以区分FeCl3溶液和Fe(OH)3胶体 |
| C、把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 |
| D、肾衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
若X、Y为同周期元素,且电负性X>Y,下列说法肯定错误的是( )
| A、X与Y形成化合物时,X显负价,Y显正价 |
| B、X的第一电离能大于Y |
| C、X的原子序数小于Y |
| D、气态氢化物的稳定性X强于Y |


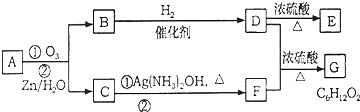
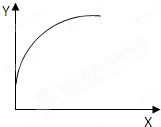 在一恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)?2C(g);△H<0.当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )
在一恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:2A(g)+B(g)?2C(g);△H<0.当达到平衡后,保持其他条件不变,只改变条件X,则相应量Y的改变一定符合图中曲线的是( )