题目内容
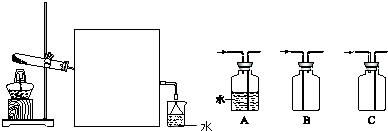
 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:(1)电源的N端为
(2)电极b上发生的电极反应为
(3)电极b上生成的气体在标准状况下的体积:
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)乙中C电极质量增加,则c处发生的反应为:Cu2++2e-=Cu,即C处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极.丙中为K2SO4,相当于电解水,根据电解前后质量分数的变化求出生成水的量,由方程式2H2+O2═2H2O可以计算整个反应中转移的电子的量,而整个电路是串联的,故每个烧杯中的电极上转移电子数是相等的;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑.
(3)根据转移电子的量,即和电极反应式进行计算即可.
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑.
(3)根据转移电子的量,即和电极反应式进行计算即可.
解答:
解:(1)乙杯中c质量增加,说明Cu沉积在c电极上,电子是从b-c移动,M是负极,N为正极,故答案为:正;
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5mol÷4=0.125mol,标况下的体积为0.125×22.4=2.8L,
故答案为:2.8L.
(2)甲中为NaOH,相当于电解H2O,阳极b处为阴离子OH-放电,即4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
③丙中为K2SO4,相当于电解水,设电解的水的质量为x.由电解前后溶质质量相等有,100×10%=(100-x)×10.47%,得x=4.5g,故为0.25mol.由方程式2H2+O2═2H2O可知,生成2molH2O,转移4mol电子,所以整个反应中转化0.5mol电子,则生成O2为0.5mol÷4=0.125mol,标况下的体积为0.125×22.4=2.8L,
故答案为:2.8L.
点评:本题为电化学知识的综合应用,做题时要注意根据电极反应现象判断出电解池的阴阳级,进而判断出电源的正负极,要注意三个电解池为串联电路,各电极上得失电子的数目相等,做题时要正确写出电极方程式,准确判断两极上离子的放电顺序.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A、原子半径:W>Z>Y>X |
| B、含Y元素的盐溶液一定显酸性 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X与氢元素组成的化合物XH5与水反应可产生两种气体 |
分类法在化学学科的发展中起到了非常重要的作用.下列分类标准合理的是( )
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据反应中是否有氧元素参与将化学反应分为氧化还原反应和非氧化还原反应
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据水溶液是否能够导电将化合物分为电解质和非电解质.
①根据氧化物的组成元素将氧化物分成酸性氧化物、碱性氧化物等
②根据反应中是否有氧元素参与将化学反应分为氧化还原反应和非氧化还原反应
③根据分散质粒子直径的大小将分散系分为溶液、胶体、浊液
④根据水溶液是否能够导电将化合物分为电解质和非电解质.
| A、③④ | B、③ | C、②③ | D、①②③④ |
将下列物质分别注入水中,振荡后静置,能分层且浮于水面上的是( )
①溴苯;②乙酸乙酯;③乙醇;④甘油;⑤油;⑥硝基苯.
①溴苯;②乙酸乙酯;③乙醇;④甘油;⑤油;⑥硝基苯.
| A、全部 | B、①②⑤⑥ |
| C、②⑤ | D、①⑥ |
 将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图的装置:(以下均假设反应过程中溶液体积不变).