题目内容
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
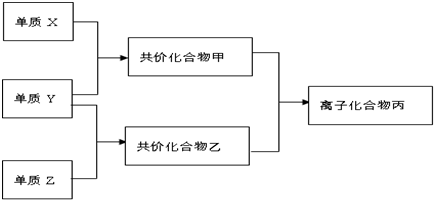
已知:a.常见双原子单质分子中,X分子含共价键最多; b.甲分子中含10个电子,
乙分子含有18个电子.
(1)X的电子式是 .
(2)实验室可用下图所示装置制备并收集甲.
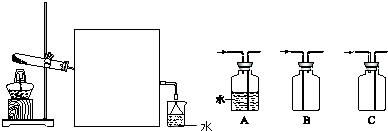
①实验室制取氨气反应的化学方程式是 .
②图中方框内收集氨气的装置可选用 (填字母序号).
③烧杯中水溶液(含酚酞)由无色变为红色,其原因是(用电离方程式表示) .
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 .
(4)实验室中检验化合物丙中阳离子的方法是 .

已知:a.常见双原子单质分子中,X分子含共价键最多; b.甲分子中含10个电子,
乙分子含有18个电子.
(1)X的电子式是
(2)实验室可用下图所示装置制备并收集甲.

①实验室制取氨气反应的化学方程式是
②图中方框内收集氨气的装置可选用
③烧杯中水溶液(含酚酞)由无色变为红色,其原因是(用电离方程式表示)
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
(4)实验室中检验化合物丙中阳离子的方法是
考点:无机物的推断
专题:推断题
分析:常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,甲分子含10个电子,乙分子含18个电子二者反应生成离子化合物,B丙应为铵盐NH4Cl,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,则化合物甲为NH3,B丙应为铵盐NH4Cl,以此解答该题.
解答:
解:常见双原子单质分子中,含共价键数目最多的是N2,即X为N2,分子中含有3个共价键,单质X、Y、Z在通常状况下均为气态,应为非金属,分别反应生成化合物甲、乙,甲分子含10个电子,乙分子含18个电子二者反应生成离子化合物,应为铵盐,Y为H2,乙为氢化物,能与氨气反应生成盐,且含有18个电子,应为HCl,则Z为Cl2,则化合物甲为NH3,B丙应为铵盐NH4Cl;
(1)X为N2,分子中氮原子之间形成3对共用电子对,电子式为 ,故答案为:
,故答案为: ;
;
(2)①试管中是制备氨气的反应,所选的试剂是NH4Cl和Ca(OH)2,反应的化学方程式为:2NH4Cl+Ca(OH)2=2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
②氨气是比空气轻的易溶于水的气体,应用向下排气方法收集,A装置水会吸收氨气收集不到气体,B装置气体导气管长进短处,氨气比空气轻不能收集,装置C气体导气管短进长出,能排净空气收集到氨气,所以收集氨气的仪器装置为C,
故答案为:C;
③氨气极易溶于水,烧杯中形成一水合氨溶液,一水合氨存在电离生成铵根离子和氢氧根离子,即NH3?H2O?NH4++OH-,显碱性,遇到酚酞由无色变为红色,
故答案为:NH3?H2O?NH4++OH-;
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,磷在氯气中燃烧可生成PCl3和PCl5,其中PCl5分子中各原子最外层不全是8电子结构,则丁为PCl5,故答案为:PCl5;
(4)上述分析可知B丙应为铵盐NH4Cl,实验室中检验化合物丙中阳离子NH4+的方法是:取少量丙固体在试管中,加入氢氧化钠溶液加热反应,用湿润的红色石蕊试纸靠近试管口,若变蓝色证明固体含有铵根离子,
故答案为:取少量丙固体在试管中,加入氢氧化钠溶液加热反应,用湿润的红色石蕊试纸靠近试管口,若变蓝色证明固体含有铵根离子.
(1)X为N2,分子中氮原子之间形成3对共用电子对,电子式为
 ,故答案为:
,故答案为: ;
;(2)①试管中是制备氨气的反应,所选的试剂是NH4Cl和Ca(OH)2,反应的化学方程式为:2NH4Cl+Ca(OH)2=2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2
| ||
②氨气是比空气轻的易溶于水的气体,应用向下排气方法收集,A装置水会吸收氨气收集不到气体,B装置气体导气管长进短处,氨气比空气轻不能收集,装置C气体导气管短进长出,能排净空气收集到氨气,所以收集氨气的仪器装置为C,
故答案为:C;
③氨气极易溶于水,烧杯中形成一水合氨溶液,一水合氨存在电离生成铵根离子和氢氧根离子,即NH3?H2O?NH4++OH-,显碱性,遇到酚酞由无色变为红色,
故答案为:NH3?H2O?NH4++OH-;
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,磷在氯气中燃烧可生成PCl3和PCl5,其中PCl5分子中各原子最外层不全是8电子结构,则丁为PCl5,故答案为:PCl5;
(4)上述分析可知B丙应为铵盐NH4Cl,实验室中检验化合物丙中阳离子NH4+的方法是:取少量丙固体在试管中,加入氢氧化钠溶液加热反应,用湿润的红色石蕊试纸靠近试管口,若变蓝色证明固体含有铵根离子,
故答案为:取少量丙固体在试管中,加入氢氧化钠溶液加热反应,用湿润的红色石蕊试纸靠近试管口,若变蓝色证明固体含有铵根离子.
点评:本题考查无机物的推断、化学实验,题目难度不大,注意把握题中信息,注意把握题中信息,认真审题,掌握常见10电子微粒、18电子微粒的应用时解题关键,学习中注重相关基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
阿波罗宇宙飞船以N2H4(联氨)和N2O4为推力源,反应温度达2700℃,反应式为2N2H4+N2O4=3N2+4H2O.关于该反应的说法中正确的是( )
| A、属于置换反应 |
| B、联氨是氧化剂 |
| C、联氨是还原剂 |
| D、氮气是氧化产物,不是还原产物 |
葡萄糖是一种单糖的主要原因是( )
| A、糖类中含碳原子数量最少 |
| B、不能再水解成更简单的糖 |
| C、分子中只有一个醛基 |
| D、糖类中结构最简单 |
下列各组离子在给定条件下能大量共存的是( )
| A、强酸性溶液中:NH4+、K+、ClO-、Cl- |
| B、有SO42-存在的溶液中:Na+、Mg2+、Ba2+、I- |
| C、加入铝粉能放出氢气的溶液中:K+、Ba2+、Cl-、Br- |
| D、在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
 (1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生
(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.该电池中负极发生



 下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: