题目内容
已知:①P4(S,白磷)+5O2(g)=P4O10(S)△H=-2983.2kJ?mol-1
②P(S,红磷)+
O2(g)=
P4O10(s)△H=-738.5kJ?mol-1
(1)写出白磷转化为红磷的热化学方程式: .
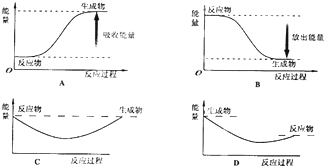
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A~D] .
②P(S,红磷)+
| 5 |
| 4 |
| 1 |
| 4 |
(1)写出白磷转化为红磷的热化学方程式:
(2)则对应下列化学反应过程中的能量变化图,能正确反映出由白磷转化为红磷的是[选填A~D]

考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)根据盖斯定律可以计算化学反应的焓变,进而书写热化学方程式;
(2)反应物的能量高于产物的能量,反应放热;反之是吸热的.
(2)反应物的能量高于产物的能量,反应放热;反之是吸热的.
解答:
解:(1)红磷转化为白磷的化学方程式为:4P(s、红磷)=P4(s、白磷),可以看成是下列两个反应方程式的和:P4(s、白磷)+5O2(g)=P4O10(s);△H=-2983.2kJ?mol-1;P4O10(s)=4P(s、红磷)+5O2(g);△H=738.5×4kJ?mol-1=2954kJ?mol-1;
根据盖斯定律,白磷转化为红磷的热化学方程式P4(s、白磷)=4P(s、红磷)△H=-2983.2kJ/mol+2954kJ?mol-1=-29.2KJ/mol,
故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol.
(2)白磷转化为红磷是放热的反应,所以反应物的能量高于产物的能量,故选B.
根据盖斯定律,白磷转化为红磷的热化学方程式P4(s、白磷)=4P(s、红磷)△H=-2983.2kJ/mol+2954kJ?mol-1=-29.2KJ/mol,
故答案为:P4(s、白磷)=4P(s、红磷)△H=-29.2KJ/mol.
(2)白磷转化为红磷是放热的反应,所以反应物的能量高于产物的能量,故选B.
点评:本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算和热化学方程式的书写知识,难度不大.

练习册系列答案
相关题目
下列反应的离子方程式书写正确的是( )
| A、硫酸铝溶液中加入过量氨水Al3++3OH-═Al(OH)3↓ | ||||
| B、碳酸钙与醋酸反应CaCO3+2H+═Ca2++CO2↑+H2O | ||||
| C、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液Fe2++2H++H2O2═Fe3++2H2O | ||||
D、电解饱和食盐水2Cl-+2H2O
|
在标准状况下,由甲烷、甲醛和乙烷组成的11.2L混合气体完全燃烧后,生成15.68L相同状况下的CO2气体.则混合气体中乙烷的体积分数为( )
| A、20% | B、40% |
| C、60% | D、80% |
下列说法正确的是( )
| A、苯滴入溴水中振荡后水层接近无色,发生了化学反应 |
| B、乙烯和乙烷都可以与氢气发生加成反应 |
| C、烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 |
| D、乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 |
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式: