题目内容
已知2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol H2O(l)=H2O(g)△H=+44kJ/mol,写出氢气和氧气反应生成液态水的热化学方程式: .
考点:热化学方程式
专题:化学反应中的能量变化
分析:根根据盖斯定律计算氢气与氧气反应生成液态水的反应热,并书热化学写方程式.
解答:
解:已知:①2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol;
②H2O(l)=H2O(g)△H=+44kJ/mol,
则氢气和氧气反应生成液态水2H2(g)+O2(g)=H2O(l)的反应可以是①-②×2得到,所以此时△H=(-483.6kJ/mol)-2×44kJ/mol=-571.6kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
②H2O(l)=H2O(g)△H=+44kJ/mol,
则氢气和氧气反应生成液态水2H2(g)+O2(g)=H2O(l)的反应可以是①-②×2得到,所以此时△H=(-483.6kJ/mol)-2×44kJ/mol=-571.6kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
点评:本题考查了热化学方程式的书写与反应热的计算,难度不大,注意掌握热化学方程式的书写是关键.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、HClO的结构式:H-Cl-O |
B、Cl-的结构示意图: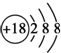 |
C、Na2O2的电子式: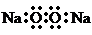 |
| D、Na原子外围电子排布式:3s1 |
国际上不提倡伊朗浓缩铀,因为铀-235(
U)是制造原子弹的燃料.
U原子核内含有中子数为( )
235 92 |
235 92 |
| A、92 | B、235 |
| C、143 | D、327 |
下列关于盐酸与醋酸两种溶液的说法正确的是( )
| A、pH相同的两溶液浓度相同 |
| B、中和等物质的量的氢氧化钠消耗的两种酸的物质的量相同 |
| C、pH相同的两溶液稀释10倍后,pH不相同 |
| D、pH=3的两溶液加入等体积的pH=3的硫酸,两溶液中c(H+)都不变 |

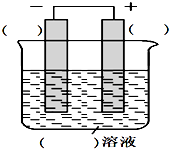 下列是构成原电池的实验方案,请按要求回答下列问题:
下列是构成原电池的实验方案,请按要求回答下列问题: