题目内容
(1)0.25mol某固体A的质量是16g,A的相对分子质量为 .
(2)在标准状况下,气体A的密度是3.170g/L,则A的摩尔质量为 .
(3)在同温同压下,气体A对空气的相对密度是3,则A的摩尔质量为 .(空气的平均相对分子质量为29)
(4)2.4g金属镁变成镁离子时失去电子的数目为 .
(2)在标准状况下,气体A的密度是3.170g/L,则A的摩尔质量为
(3)在同温同压下,气体A对空气的相对密度是3,则A的摩尔质量为
(4)2.4g金属镁变成镁离子时失去电子的数目为
考点:物质的量的相关计算
专题:计算题
分析:(1)依据M=
计算摩尔质量,摩尔质量以g/mol为单位,数值上等于其相对分子质量;
(2)在标准状况下,根据密度与摩尔质量、气体摩尔体积的关系计算;
(3)在同温同压下,气体密度之比等于摩尔质量之比;
(4)依据镁原子的结构分析;
| m |
| n |
(2)在标准状况下,根据密度与摩尔质量、气体摩尔体积的关系计算;
(3)在同温同压下,气体密度之比等于摩尔质量之比;
(4)依据镁原子的结构分析;
解答:
解:(1)依据M=
计算摩尔质量=
=64g/mol,摩尔质量以g/mol为单位,数值上等于其相对分子质量为64;
故答案为:64;
(2)在标准状况下,ρ=
=
=
=3.170g/L,所以M=71 g/mol,
故答案为:71 g/mol;
(3)在同温同压下,气体密度之比等于摩尔质量之比,气体A与空气的密度之比为3,M:29=3:1,M=87,A的摩尔质量87g/mol;
故答案为:87g/mol;
(4)镁原子最外层电子数为2,2.4g金属镁物质的量为
=0.1mol,变成镁离子时失去的电子数目为0.2NA,
故答案为:0.2NA;
| m |
| n |
| 16g |
| 0.25mol |
故答案为:64;
(2)在标准状况下,ρ=
| m |
| V |
| nM |
| nVm |
| M |
| 22.4L/mol |
故答案为:71 g/mol;
(3)在同温同压下,气体密度之比等于摩尔质量之比,气体A与空气的密度之比为3,M:29=3:1,M=87,A的摩尔质量87g/mol;
故答案为:87g/mol;
(4)镁原子最外层电子数为2,2.4g金属镁物质的量为
| 2.4g |
| 24g/mol |
故答案为:0.2NA;
点评:本题考查了不同条件下,质量、摩尔质量、微粒个数、密度等物理量间的关系,侧重考查学生对物质的量的概念的外延和内涵的理解,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某校科研小组的同学设计了如图实验装置,下列判断中正确的是( )


| A、烧杯a中的溶液pH升高 |
| B、铁片作负极 |
| C、烧杯a中发生反应为2H++2e-═H2↑ |
| D、烧杯b中有氯气产生 |
依据元素周期表示元素周期律,下列推断正确的是( )
| A、HCl HBr HI的热稳定性依次增强 |
| B、Mg(OH)2的碱性比Be(OH)2的强 |
| C、H3BO3的酸性比H2CO3的强 |
| D、若M+和R2-的核外电子层结构相同,则原子序数:R>M |
下列说法中,不正确的是( )
| A、利用丁达尔效应可以区分CuSO4溶液和Fe(OH)3胶体 |
| B、将液态物质加热至沸点,使之汽化,再重新冷凝为液体的操作过程称为蒸馏 |
| C、葡萄糖、蔗糖、淀粉、纤维素都是可溶于水的糖类物质 |
| D、蛋白质在一定条件下能发生水解反应,最终转化为氨基酸 |
下列有关化学用语表示正确的是( )
| A、HClO的结构式:H-Cl-O |
B、Cl-的结构示意图: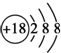 |
C、Na2O2的电子式: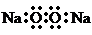 |
| D、Na原子外围电子排布式:3s1 |
下列各组离子中,能在溶液中大量共存的是( )
| A、H+、Cu2+、OH-、NO3- |
| B、H+、K+、Cl-、ClO- |
| C、Fe3+、Na+、Cl-、SO42- |
| D、Na+、Ba2+、SO42-、OH- |
下列事实不能证明氨水是弱碱的是( )
| A、pH=11的氨水加入水稀释到原溶液体积100倍时,pH大于9 |
| B、氯化铵溶液呈酸性 |
| C、常温下0.01 mol/L氨水的pH=10.6 |
| D、体积相同的0.1 mol/L氨水和0.1 mol/L NaOH溶液中和盐酸的量相同 |