题目内容
标准状况下,将V L A气体(摩尔质量为Mg/mol)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度(mol/L)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算标况下VL该气体的物质的量,再利用m=nM计算该气体的质量,溶剂和溶质的质量和为溶液的质量,然后利用V=
计算溶液的体积,最后利用c=
计算该溶液的物质的量浓度.
| V |
| 22.4L/mol |
| m |
| ρ |
| n |
| V |
解答:
解:标准状况下,气体的物质的量为
=
mol,该气体的质量为:
mol×M g?mol-1=
g,
0.1L水的质量为:100mL×1g/mL=100g,则溶液的质量为:
g+100g,
所以该溶液的体积为:
=
L,
则该溶液的物质的量浓度为:c=
=
=
mol/L,
故选B.
| VL |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| VM |
| 22.4 |
0.1L水的质量为:100mL×1g/mL=100g,则溶液的质量为:
| VM |
| 22.4 |
所以该溶液的体积为:
| ||
| 1000dg/L |
| VM+2240 |
| 22400d |
则该溶液的物质的量浓度为:c=
| n |
| V |
| ||
|
| 1000dV |
| VM+2240 |
故选B.
点评:本题考查物质的量浓度的计算,题目难度中等,利用字母计算加大了计算难度,明确溶质质量分数、物质的量浓度的概念为解答关键,注意计算溶液的体积的方法,试题侧重考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是( )
| A、2NO2?N2O4 (正反应为放热反应) |
| B、C(s)+CO2?2CO (正反应为吸热反应) |
| C、N2+3H2?2NH3 (正反应为放热反应) |
| D、H2S?H2+S(s)(正反应为吸热反应) |
在水溶液中能大量共存的一组离子是( )
| A、K+、Ba2+、NO3-、Cl- |
| B、H+、Fe2+、ClO-、Cl- |
| C、Na+、Ag+、Cl-、SO42- |
| D、Al3+、Na+、HCO3-、SO42- |
在一固定容积的密闭容器中进行如下反应:N2+3H2?2NH3 △H<O,在一定温度下反应达到平衡状态,若将平衡体系中各物质的浓度都增加到原来的2倍,下列叙述正确的是( )
| A、化学平衡不发生移动 |
| B、化学平衡向正反应方向移动 |
| C、化学平衡向逆反应方向移动 |
| D、正反应速率增大,逆反应速率减小 |
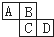 如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.
如图为周期表中的一部分.已知A、B、C、D均为短周期元素,A与D原子序数之和为C原子序数的1.5倍.