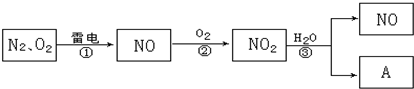
题目内容
下列实验能达到相应目的是( )
A、 制备少量的氧气 |
B、 证明氧化性Cl2>Br2>I2 |
C、 将海带灼烧成灰 |
D、 说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
考点:化学实验方案的评价
专题:
分析:A.过氧化钠为粉末固体,隔板不能使固体与液体分离;
B.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱;
C.灼烧海带,应在坩埚中;
D.浓硫酸具有脱水性和强氧化性,向蔗糖中加入浓硫酸变黑,放热,体积膨胀,碳和浓硫酸之间反应放出刺激性气体SO2.
B.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱;
C.灼烧海带,应在坩埚中;
D.浓硫酸具有脱水性和强氧化性,向蔗糖中加入浓硫酸变黑,放热,体积膨胀,碳和浓硫酸之间反应放出刺激性气体SO2.
解答:
解:A.过氧化钠为粉末固体,隔板不能使固体与液体分离,则图中装置不能控制反应速率,故A错误;
B.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱,应先将溴中的氯气除去,故B错误;
C.灼烧海带,应在坩埚中,不能在蒸发皿中灼烧,故C错误;
D.向蔗糖中加入浓硫酸变黑,说明浓硫酸具有脱水性,有二氧化硫生成,说明有强氧化性,二氧化硫使品红褪色,说明有漂白性,使酸性高锰酸钾褪色,说明有还原性,故D正确.
故选D.
B.生成的溴中混有氯气,不能证明溴与碘的氧化性强弱,应先将溴中的氯气除去,故B错误;
C.灼烧海带,应在坩埚中,不能在蒸发皿中灼烧,故C错误;
D.向蔗糖中加入浓硫酸变黑,说明浓硫酸具有脱水性,有二氧化硫生成,说明有强氧化性,二氧化硫使品红褪色,说明有漂白性,使酸性高锰酸钾褪色,说明有还原性,故D正确.
故选D.
点评:本题考查化学实验方案的评价,涉及物质的制备以及物质的性质比较等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )
1丁醇CH3CH2CH2CH2OH和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如图,下列对该实验的描述错误的是( )| A、不能用水浴加热 |
| B、长玻璃管起冷凝回流作用 |
| C、1-丁醇和乙酸能反应完或者有一种能消耗完 |
| D、为了提高反应速率,所以要加入浓硫酸做催化剂并加热 |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是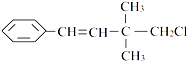 ( )
( )
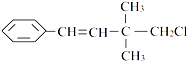 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
除去NaCl固体中少量泥沙,肯定不会涉及的操作是( )
| A、溶解 | B、蒸馏 | C、搅拌 | D、过滤 |
钙是人体必需的常量元素,成年人每天需要800毫克的钙,下列补钙的途径正确的是( )
| A、经常饮用咖啡、碳酸饮料 |
| B、经常饮用钙离子含量高的硬水 |
| C、经常饮用牛奶、豆奶 |
| D、大量补充维生素C |