题目内容
以下各微粒中,所有原子或离子不满足最外层都为8电子结构的是( )
| A、Na2O2 |
| B、PCl3 |
| C、CCl4 |
| D、BF3 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:根据原子的最外层电子数来分析物质中所含原子或离子的最外层是否达8电子稳定结构,分子中中心原子的最外层电子数与成键数之和为8,则分子中所有原子都满足最外层8电子结构.
解答:
解:A、Na2O2中O原子之间有一对共用电子对,又从Na处得到2个电子,所以最外层都是8个电子,每个Na失去一个电子,最外层变成8电子,故A错误;
B、PCl3中,P最外层有5个电子,与三个Cl形成三对共用电子对,达8电子结构,Cl与P形成一对共用电子对,也达8电子结构,故 B错误;
C、CCl4中,C最外层有4个电子,与四个Cl形成四对共用电子对,达8电子结构,Cl与C形成一对共用电子对,也达8电子结构,故C错误;
D、BF3中,B最外层只有3个电子,与三个F形成三对共用电子对,最外层有6个电子,不满足8电子结构,故D正确;
故选D.
B、PCl3中,P最外层有5个电子,与三个Cl形成三对共用电子对,达8电子结构,Cl与P形成一对共用电子对,也达8电子结构,故 B错误;
C、CCl4中,C最外层有4个电子,与四个Cl形成四对共用电子对,达8电子结构,Cl与C形成一对共用电子对,也达8电子结构,故C错误;
D、BF3中,B最外层只有3个电子,与三个F形成三对共用电子对,最外层有6个电子,不满足8电子结构,故D正确;
故选D.
点评:本题考查最外层8电子结构,注意共价化合物中原子达8电子结构的判断方法:原子的最外层电子数+化合价的绝对值=8,就达8电子结构,否则不是.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处.在一定条件下发生可逆反应:2A(g)+B(g)?2C(g),反应达到平衡后,恢复到反应发生前时的温度.下列有关说法不正确的是( )| A、根据隔板K滑动与否可判断左右两边的反应是否达到平衡 |
| B、达到平衡后,隔板K最终停留在左侧刻度0--2之间 |
| C、到达平衡时,甲容器中C的物质的量大于乙容器中C的物质的量 |
| D、若平衡时K停留在左侧1处,则活塞仍停留在右侧6处 |
最外层为N层的基态原子中,未成对的电子数目最多为( )个.
| A、4 | B、5 | C、6 | D、7 |
某有机物其结构简式如图关于该有机物,下列叙述不正确的是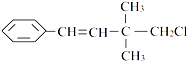 ( )
( )
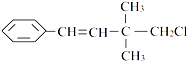 ( )
( )| A、一定条件下,能发生加聚反应 |
| B、能使溴水褪色 |
| C、一定条件下,能发生取代反应 |
| D、能与NaOH的醇溶液共热发生消去反应 |
已知反应:2M(g)+N(g)+P(g)
2Q(g)+3R(g)△H>0,在恒容的密闭容器中,下列有关说法正确的是( )
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,增加M的浓度,N的转化率减小 |
| B、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| C、单位时间内消耗N和Q的物质的量比为1:1时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,N和P的转化率增大 |

