题目内容
某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
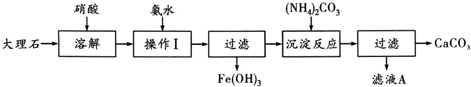
(1)溶解大理石时,用硝酸而不用硫酸的原理是: .
(2)操作Ⅰ的目的是: ,该反应的离子方程式是: .
(3)写出加入(NH4)2CO3所发生反应的离子方程式: ,滤液A的一种用途是 .

(1)溶解大理石时,用硝酸而不用硫酸的原理是:
(2)操作Ⅰ的目的是:
(3)写出加入(NH4)2CO3所发生反应的离子方程式:
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,(Fe(OH)3在弱酸性环境下就能沉淀),然后在滤液中加入碳酸铵,可以得到碳酸钙以及硝酸铵,滤液溶质是NH4NO3,可以用作化肥.
解答:
解:(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生,故答案为:硫酸钙微溶于水;
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,当溶质只能是共价化合物时为氨水,发生的反应为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:除Fe3+离子;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,滤液B的溶质是NH4NO3,可以用作化肥,
故答案为:Ca2++CO32-=CaCO3↓;做化肥.
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去,当溶质只能是共价化合物时为氨水,发生的反应为:Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,
故答案为:除Fe3+离子;Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+;
(3)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应后的离子方程式为Ca2++CO32-=CaCO3↓,滤液B的溶质是NH4NO3,可以用作化肥,
故答案为:Ca2++CO32-=CaCO3↓;做化肥.
点评:本题考查物质的分离、提纯和除杂等实验问题,题目难度不大,为上海高考题的改编题,注意实验基本操作方法,把握实验原理.

练习册系列答案
相关题目
一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断一定正确的是( )
| A、c(A-)≧c(M+) |
| B、c(A-)=c(M+) |
| C、若MA不水解,则c(OH-)<c(H+) |
| D、若MA水解,则c(OH-)>c(H+) |
NaCl溶液中混有Na2S和NaI,为了除去杂质,并将杂质逐一分离,选用如下操作:
①通入Cl2;②加碘水;③用CCl4萃取;④过滤;⑤分液.其操作顺序正确的是( )
①通入Cl2;②加碘水;③用CCl4萃取;④过滤;⑤分液.其操作顺序正确的是( )
| A、①②③④⑤ |
| B、②④①③⑤ |
| C、④⑤③②① |
| D、⑤②①④③ |
将氯水注入KI溶液中,用力振荡,再注入四氯化碳,振荡后静置,看到的现象是( )
| A、液体呈无色 |
| B、液体分两层,上层为紫色,下层接近无色 |
| C、液体呈紫红色 |
| D、液体分两层,上层接近无色,下层为紫色 |
下列各组有机物,无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值的是( )
| A、C2H6和C3H8 |
| B、C5H10和C6H6 |
| C、C2H6O和C2H4O2 |
| D、C4H8和C3H8O |
用石墨作电极电解CuCl2溶液,当通电一段时间后,阳极收集到2.24L气体(标准状况).下列有关说法正确的是( )
| A、阴极生成的铜为5.6g |
| B、上述电解过程中共转移0.2 mol电子 |
| C、电解得到的Cu的物质的量为0.5mol |
| D、电解后溶液呈碱性 |
铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+
2Pb2++2H2O.下列有关新型液流式铅酸蓄电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、放电时,蓄电池由化学能转化为电能 |
| B、充放电时,溶液的导电能力变化不大 |
| C、放电时的负极反应式为:Pb-2e-=Pb2+ |
| D、充电时的阳极反应式为:Pb2++4OH-+2e-=PbO2+2H2O |
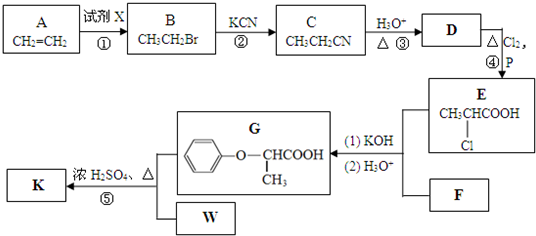
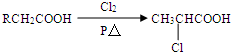
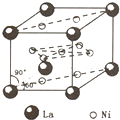 氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(
氢是新型清洁能源,但难储运,研究发现,合金可用来储藏氢气,镧(