题目内容
5.电解质有强弱之分,以下物质属于强电解质的是( )| A. | 水 | B. | 氨水 | C. | 醋酸 | D. | 氯化钠 |
分析 在水溶液中能够完全电离的电解质为强电解质,在溶液中部分电离的电解质为弱电解质,弱电解质存在电离平衡,据此进行判断.
解答 解:A.水是弱电解质,存在电离平衡,故A错误;
B.氨水为混合物,不属于电解质,故B错误;
C.醋酸为弱酸,水溶液中存在电离平衡,为弱电解质,故C错误;
D.氯化钠是盐,水溶液中完全电离,为强电解质,故D正确;
故选D.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意掌握强电解质与弱电解质、电解质与非电解质的概念及根本区别.

练习册系列答案
相关题目
15.标准状况下,0.1mol某烃与1molO2(过量)混和,完全燃烧后通过足量的过氧化钠固体,固体增重15克,从过氧化钠中逸出的全部气体为16.8L(标准状况),则该烃的分子式为( )
| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
13.有关阿佛加德罗常数(NA),下列说法中正确的是( )
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
20.模型在研究物质的结构和变化有很重要的作用.如图表示乙烯(C2H4)、甲醛(HCHO)和物质甲的分子结构模型.下列叙述错误的是( )


| A. | 物质甲的分子式为C2H4O2 | |
| B. | 若物质甲具有酸性,则乙烯和甲醛一定具有酸性 | |
| C. | 物质甲、乙烯和甲醛分子都具有双键 | |
| D. | 若三种物质在空气中完全燃烧,生成的产物相同 |
10.下列电离方程式错误的是( )
| A. | KCl=K++Cl- | B. | H2CO3?2 H++CO32- | ||
| C. | H2SO4=2H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
17.下列离子方程式书写正确的是( )
| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
14.依据反应原理回答下列问题:
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.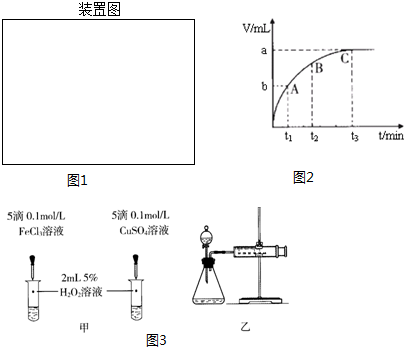
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.
