题目内容
10.下列电离方程式错误的是( )| A. | KCl=K++Cl- | B. | H2CO3?2 H++CO32- | ||
| C. | H2SO4=2H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
分析 氯化钾、硫酸、氢氧化钡为强电解质,在溶液中完全电离,碳酸为弱酸,电离方程式分步书写,主要写出第一步的电离即可,据此进行解答.
解答 解:A.KCl为强电解质,在溶液中完全电离出钾离子和氯离子,其电离方程式为:KCl=K++Cl-,故A正确;
B.碳酸为弱酸,以第一步电离为主,电离方程式写出第一步即可,正确的电离方程式为:H2CO3?H++HCO3-,故B错误;
C.硫酸为强电解质,在溶液中完全电离出硫酸根离子和氢离子,其电离方程式为:H2SO4=2H++SO42-,故C正确;
D.氢氧化钡为强电解质,其电离方程式为:Ba(OH)2=Ba2++2OH-,故D正确;
故选B.
点评 本题考查了电离方程式的书写方法,题目难度不大,明确强弱电解质的概念为解答关键,注意掌握电离方程式的书写原则,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
20.下列有关原子及元素周期表的说法,错误的是( )
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
| A. | ①⑤⑥⑦ | B. | ①③⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②③④⑥⑧ |
18.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: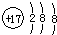 | |
| B. | 作为相对原子质量测定标准的碳核素:12C | |
| C. | 氨气(NH3)中氮元素的化合价是+3 | |
| D. | 乙醇的结构简式:C2H5OH |
5.电解质有强弱之分,以下物质属于强电解质的是( )
| A. | 水 | B. | 氨水 | C. | 醋酸 | D. | 氯化钠 |
15.已知反应3A(g)+B(g)?2C(g) 在密闭容器中进行,5秒钟后C的浓度增加了0.4mol/L,则这段时间内用B表示的平均反应速率为( )
| A. | 0.02 mol/(L•s) | B. | 0.04 mol/(L•s) | C. | 0.08 mol/(L•s) | D. | 0.12 mol/(L•s) |
19.下列分子中所有原子都满足最外层为8电子结构的是( )
①BeCl ②NC13 ③PCl5④COC12⑤SF6⑥XeF2⑦CS2⑧CH4⑨CF2C12⑩S2C12.
①BeCl ②NC13 ③PCl5④COC12⑤SF6⑥XeF2⑦CS2⑧CH4⑨CF2C12⑩S2C12.
| A. | ②④⑦⑧⑧⑨⑩ | B. | ②④⑦⑨⑩ | C. | ③④⑦⑩ | D. | ③④⑤⑦⑨⑩ |
20.下列关于化学反应速率的说法正确的是( )
| A. | 化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加 | |
| B. | 化学反应速率为“0.8 mol•L-1•s-1”所表示的意思是:时间为1 s时,某物质的浓度为0.8 mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应现象越明显,反应速率越大 |

 ;
; ;
; ;
;
 )
) (其中两种)(任写两种)
(其中两种)(任写两种)