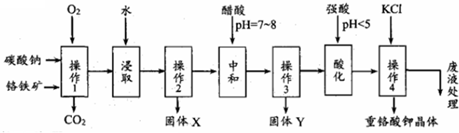
题目内容
15.分类方法在化学学科的发展中起着非常重要的作用.下列分类标准合理的是( )| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
分析 A、根据化合物的水溶液或熔融态能否导电判断电解质和非电解质;
B、根据反应中的热效应将化学反应分类;
C.强弱电解质是根据其电离程度划分的;
D.化学反应中元素化合价发生变化是氧化还原反应的判断依据.
解答 解:A、根据化合物的水溶液或熔融态能否导电将化合物分为电解质和非电解质,故A错误;
B、根据反应中的热效应将化学反应分为吸热反应和放热反应,故B正确;
C.溶液的导电能力与自由移动离子的浓度有关,与电解质强弱无关,电解质强弱是根据其电离程度划分的,故C错误;
D.化合价变化为氧化还原反应的特征,根据化学反应中元素化合价是否发生变化把反应分为氧化还原反应和非氧化还原反应应,不是元素的化合价的高低,故D错误;
故选B.
点评 本题考查氧化还原反应、电解质非电解质、强弱电解质、化学反分类的依据分析判断,题目难度不大,明确氧化还原反应的概念及特征为解答关键,注意掌握电解质与非电解质、强电解质和弱电解质的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.下列关于物质应用的说法错误的是( )
| A. | 玻璃容器可长期盛放各种酸 | |
| B. | 水中加入明矾、硫酸铁溶液可以起净水作用 | |
| C. | Al2O3可制造耐高温的实验仪器 | |
| D. | Na2S可除去污水中有毒的Cu2+ |
5.游泳池是公共场合,必须保持用水的清洁卫生,游泳池中的水常用漂白粉消毒,漂白粉的有效成分是( )
| A. | CaCl2 | B. | Ca(ClO)2 | C. | Ca(OH)2 | D. | HClO |
6.某温度下,水的电离平衡常数K电离=1.8×10-15,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合(不考虑体积变化),所得混合溶液的pH=10,则强碱与强酸的体积比约为( )
| A. | 5.6﹕1 | B. | 9﹕1 | C. | 1﹕5.6 | D. | 1﹕9 |
 .
.