题目内容
6.某温度下,水的电离平衡常数K电离=1.8×10-15,则该温度下,pH=12的强碱溶液与pH=2的强酸溶液混合(不考虑体积变化),所得混合溶液的pH=10,则强碱与强酸的体积比约为( )| A. | 5.6﹕1 | B. | 9﹕1 | C. | 1﹕5.6 | D. | 1﹕9 |
分析 某温度下,水的电离平衡常数K电离=1.8×10-15,可知中性时7<pH<8,所得混合溶液的pH=10,可知强碱过量,设强碱与强酸的体积分别为x、y,则$\frac{x×\frac{1.8×1{0}^{-15}}{1{0}^{-12}}-y×1{0}^{-2}}{x+y}$=$\frac{1.8×1{0}^{-15}}{1{0}^{-10}}$,以此来解答.
解答 解:某温度下,水的电离平衡常数K电离=1.8×10-15,所得混合溶液的pH=10,可知强碱过量,设强碱与强酸的体积分别为x、y,
则$\frac{x×\frac{1.8×1{0}^{-15}}{1{0}^{-12}}-y×1{0}^{-2}}{x+y}$=$\frac{1.8×1{0}^{-15}}{1{0}^{-10}}$,解得x:y≈5.6﹕1,
故选A.
点评 本题考查酸碱混合的计算,为高频考点,把握混合后碱过量、pH与浓度的关系为解答的关键,侧重分析与计算能力的考查,注意电离平衡常数的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.分类方法在化学学科的发展中起着非常重要的作用.下列分类标准合理的是( )
| A. | 根据物质能否导电将物质分为电解质和非电解质 | |
| B. | 根据反应中的热效应将化学反应分为放热反应和吸热反应 | |
| C. | 根据溶液导电性强弱将电解质分为强电解质和弱非电解质 | |
| D. | 根据元素的化合价的高低将化学反应分为氧化还原反应和非氧化还原反应 |
17.根据下列能量变化示意图,分析下列说法中正确的是( )


| A. | A(g)+B(g)→C(g)+D(l)是放热反应 | |
| B. | A(g)+B(g)→C(g)+D(l)是吸热反应 | |
| C. | C(g)+D(l)→A(g)+B(g)是放热反应 | |
| D. | C(g)+D(l)具有的能量大于A(g)+B(g)具有的能量 |
14.下列各组金属均有导线相连,并插入对应的液体中,其中不能组成原电池的是( )
| A. | Zn|H2SO4(稀)|C | B. | Cu|AgNO3(aq)|Ag | C. | Zn|CCl4|Cu | D. | Fe|H2SO4(稀)|Cu |
1.甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
由表中数据判断反应I为放热反应(填“吸”或“放”).
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:
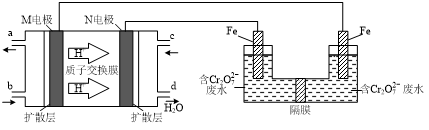
①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)?CH3OH(g)△H
?下表所列数据是该反应在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
?某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为80%,此时的温度为250℃(从表中选择).
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=(△H1-△H2+4△H3)/2kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72?)时,实验室利用如图装置模拟该法:

①N电极的电极反应式为O2+4e?+4H+=2H2O.
②请完成电解池中Cr2O72?转化为Cr3+的离子反应方程式:
Cr2O72?+6Fe2++14H+═2Cr3++6Fe3++7H2O
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10?5mol•L-1 时,Cr3+沉淀完全,此时溶液的pH=5.6. (已知,Ksp=6.4×10?31,lg2=0.3)
11.甲酸香叶酯是一种食品香料.可以由香叶醇与甲酸发生酯化反应制得.
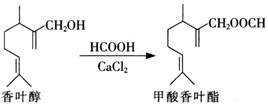
下列说法中正确的是( )

下列说法中正确的是( )
| A. | 香叶醇分子中含有1个手性碳原子 | |
| B. | 香叶醇可发生消去、加成、氧化反应 | |
| C. | 1 mol甲酸香叶酯可以与1molNaOH反应 | |
| D. | 甲酸香叶酯分子中所有碳原子均可能共平面 |
18.下列化学方程式不正确的是( )
| A. | 乙醇与浓氢溴酸反应:CH3CH2OH+HBr $\stackrel{△}{→}$CH3CH2Br+H2O | |
| B. | 溴乙烷与氢氧化钠溶液共热:CH3CH2Br+NaOH$\stackrel{△}{→}$CH3CH2OH+NaBr | |
| C. | 苯酚钠溶液中通入少量二氧化碳: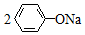 +CO2→ +CO2→ +Na2CO3 +Na2CO3 | |
| D. | 蔗糖在稀硫酸作用下水解:C12H22O11(蔗糖)+H2O$→_{△}^{稀硝酸}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
16.下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是( )
| 组别 物质 | 甲 | 乙 | 丙 |
| A | Al2O3 | H2SO4 | NaOH |
| B | NO2 | HNO3 | NH3 |
| C | SiO2 | HF | NaOH |
| D | SO2 | Ca(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |