题目内容
2.有一含有Na+、Mg2+、Cl-、SO42-的溶液,已知Na+、Mg2+、Cl-的个数之比为3:7:9,则Cl-与SO42-的个数比为( )| A. | 9:4 | B. | 4:9 | C. | 2:1 | D. | 1:2 |
分析 溶液呈电中性,设硫酸根离子个数为y,分别计算阳离子所带正电荷总数和阴离子负电荷总数,依据电荷守恒规律解答.
解答 解:设硫酸根离子个数为y,则依据溶液电中性规律得:3×1+7×2=9×1+y×2,解得y=4,则Cl-与SO42-的个数比为9:4,
故选:A.
点评 本题考查物质的量浓度的有关计算,难度中等,注意电解质的混合溶液中离子浓度的计算,经常利用电荷守恒计算.

练习册系列答案
相关题目
8.下列根据实验操作和现象所得出的结论不正确的是( )
| 选项 | 实验操作与现象 | 结论 |
| A | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| B | 测定浓度均为0.1mol•L-1 CH3COONa与HCOONa溶液的pH,CH3COONa溶液的pH较大 | 酸性:CH3COOH>HCOOH |
| C | 苯酚的浊液中加入碳酸钠溶液,溶液变为无色 | 酸性:苯酚>碳酸氢钠溶液 |
| D | 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加3滴0.1mol•L-1 AgNO3溶液,出现黄色沉淀 | 溶解度:AgI<AgCl |
| A. | A | B. | B | C. | C | D. | D |
13.下列说法正确的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑是水作还原剂的氧化还原反应 | |
| B. | 1mol Na2O2固体中含离子总数为4NA | |
| C. | 用灼烧的方法除去Na2CO3中的NaHCO3 | |
| D. | NaHCO3溶液中加入稀盐酸:CO32-+2H+═CO2↑+H2O |
10.下列叙述正确的是( )
| A. | NaCl溶液在电流作用下电离成Na+和Cl- | |
| B. | 溶于水后能够电离出H+的化合物都是酸 | |
| C. | 氯化氢溶于水形成的溶液能够导电,所以氯化氢是电解质 | |
| D. | CO2溶于水形成的溶液能够导电,所以CO2是电解质 |
17.下列有关实验操作、现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | 两试管各加入5ml 0.1mol/L Na2S2O3溶液,同时分别滴入5ml 0.1mol/L硫酸和盐酸 | 两支试管同时变浑浊 | 其它条件不变时,Cl-一定有催化效果 |
| C | A1箔插入稀HNO3中 | 无现象 | A1箔表面被HNO3氧化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
7.利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池.下列说法正确的是( )
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- | |
| C. | 外电路电子由负极流向正极,内电路电子由正极流向负极 | |
| D. | 电池放电过程中,溶液的PH不断降低 |
14.下列离子方程式书写正确的是( )
| A. | 碳酸氢钠溶液中加稀盐酸入:HCO3-+H+═CO2↑+H2O | |
| B. | 碳酸钡和稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 铜片插入硝酸银溶液:Cu+Ag+═Cu2++Ag | |
| D. | 把金属铁放入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
11.下列有关化学用语表示正确的是( )
| A. | N2的电子式: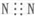 | |
| B. | S2-的结构示意图: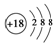 | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{58}^{131}$I | |
| D. | 乙烯的分子式:CH2=CH2 |
12.NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 | |
| B. | 常温常压下,5.6g乙烯与丁烯(C4H8)的混合物中氢原子数为0.8NA | |
| C. | 标准状况下,4.48 LCl2与足量的Fe反应转移电子数为0.4NA | |
| D. | 0.1 mol H218O与D2O的混合物中中子数为NA |