题目内容
7.利用CH4和O2的反应,在KOH溶液中用铂作电极可以构成原电池.下列说法正确的是( )| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 在负极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- | |
| C. | 外电路电子由负极流向正极,内电路电子由正极流向负极 | |
| D. | 电池放电过程中,溶液的PH不断降低 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,原电池工作时,电子从负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动,据此分析.
解答 解:A、通入CH4的电极为负极,电极反应为:CH4+10OH--8e-=CO32-+7H2O,每消耗1molCH4可以向外电路提供8mole-,故A错误;
B、在正极上O2获得电子,电极反应式为 O2+2H2O+4e-=4OH-,故B错误;
C、外电路电子由负极流向正极,内电路电子不能流动个,故C错误;
D、电池反应式为:CH4+2OH-+2O2=CO32-+3H2O,随着反应的进行,溶液中氢氧根离子不断减少,溶液pH不断降低,故D正确.
故选D.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应,在学习中注意积累电子、电流、离子的流向.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
13.化学用语是学习化学的重要工具,下列化学用语书写正确的是( )
| A. | NH3分子的电子式: | |
| B. | 次氯酸的结构式:H-Cl-O | |
| C. | CH4分子的结构式: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
18.化学与人类生产、生活、社会可持续发展密切相关,下列说法错误的是( )
| A. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硅胶 | |
| B. | “天宫一号”中使用的碳纤维,是一种新型无机非金属材料 | |
| C. | 二氧化硅可用于光纤通信、单晶硅可用于光电转换 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物 |
15.下列说法不正确的是( )
| A. | 目前加碘食盐中含碘元素的物质主要是KIO3 | |
| B. | 维生素C具有还原性,可用作食品抗氧化剂 | |
| C. | 向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
2.有一含有Na+、Mg2+、Cl-、SO42-的溶液,已知Na+、Mg2+、Cl-的个数之比为3:7:9,则Cl-与SO42-的个数比为( )
| A. | 9:4 | B. | 4:9 | C. | 2:1 | D. | 1:2 |
12.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 苏打--NaHCO3 | B. | 醋酸--C2H5OH | C. | 明矾-KAl(SO4)2 | D. | 生石灰-CaO |
19.向二氯化铂的HCl溶液中通入乙烯气体,再加入KCl可得K[Pt(C2H4)Cl3]•H2O (蔡氏盐),下列有关化学用语表示正确的是( )
| A. | KCl的电子式: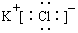 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 中子数为117,质子数为78 的铂原子:${\;}_{117}^{195}Pt$ | |
| D. | K+的结构示意图: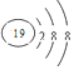 |
16.下列物质中,不能由单质直接化合生成的是( )
①CuS ②NH3 ③SO3 ④FeCl3 ⑤NO2.
①CuS ②NH3 ③SO3 ④FeCl3 ⑤NO2.
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
17.设NA表示阿伏加德罗常数的值.下列有关说法中正确的是( )
| A. | 常温常压下,46 gN2O4中含氧原子数为2NA | |
| B. | 常温常压下,11.2 LNH3中含共价键的数目为1.5NA | |
| C. | 电解精炼铜阳极质量减少32 g时电路中转移电子总数为NA | |
| D. | 1 L 0.2 mol/LNa2SO4溶液中含有阴阳离子总数为0.6NA |