题目内容
8.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,Y、Z是金属元素,Y的单质能与水剧烈反应,Z可形成含氧酸根离子;X与W同主族,且可形成原子个数比为2:l、3:1的两种常见物质.下列说法正确的是( )| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
分析 X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W同主族,且可形成原子个数比为2:l、3:1的两种常见物质,则X为O、W为S元素;Y、Z是金属元素,Y的单质能与水剧烈反应,则Y为Na元素;Z可形成含氧酸根离子,则Z为Al元素,据此结合元素周期律知识进行解答.
解答 解:X、Y、Z、W是原子序数依次增大的四种短周期主族元素,X与W同主族,且可形成原子个数比为2:l、3:1的两种常见物质,则X为O、W为S元素;Y、Z是金属元素,Y的单质能与水剧烈反应,则Y为Na元素;Z可形成含氧酸根离子,则Z为Al元素,
A.Y为Na、Z为Al,金属钠与溶液中水反应,不会在溶液中置换出Al,故A错误;
B.非金属性O>S,则最简单氢化物的稳定性:X>W,故B错误;
C.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径大小为:W>X>Y>Z,故C正确;
D.X为O,Y为Na,Z为Al,O与Na形成的化合物过氧化钠中含有共价键和离子键,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意掌握离子半径、氢化物稳定性的方法,试题培养了学生的灵活应用能力.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
18.某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果.
实验Ⅰ(图1)
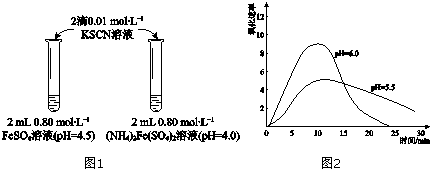
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是NH4++H2O?NH3•H2O+H+(用化学用语表示).溶液的稳定性:
FeSO4<(NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
(3)乙同学提出实验Ⅰ中两溶液的稳定性差异是溶液酸性不同导致,进行实验Ⅲ:分别配制0.80mol•L-1 pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短.资料显示:亚铁盐溶液中存在反应 4Fe2++O2+10H2O?4Fe(OH)3+8H+.由实验Ⅲ,乙同学可得出的结论是溶液pH越小,Fe2+越稳定,原因是溶液中存在平衡4Fe2++O2+10H2O?4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定.
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是生成的Fe(OH)3对反应有催化作用.
(5)综合以上实验,增强Fe2+稳定性的措施有加一定量的酸,密封保存.
实验Ⅰ(图1)

| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
FeSO4<(NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是生成的Fe(OH)3对反应有催化作用.
(5)综合以上实验,增强Fe2+稳定性的措施有加一定量的酸,密封保存.
19.处于固体状态的下列物质,其晶体类型按照离子晶体、分子晶体、原子晶体顺序排列的是( )
| A. | CH3COONH4、H2O、水晶 | B. | H2SO4、硫磺、石墨 | ||
| C. | KOH、SO3、Ar | D. | Ba(OH)2、玻璃、金刚石 |
16.有机物甲、乙的结构如图所示.下列说法错误的是( )
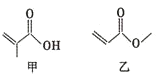
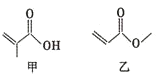
| A. | 甲、乙互为同分异构体 | |
| B. | 一定条件下,甲、乙均能发生取代反应 | |
| C. | 甲、乙都能与金属钠反应生成氢气 | |
| D. | 甲、乙都能使酸性KMnO4溶液褪色 |
3.下列关于金属腐蚀与防护的说法不正确的是( )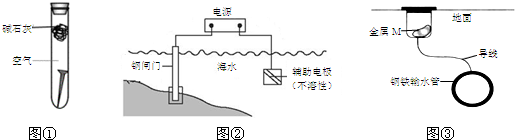

| A. | 图①,放置于干燥空气中的铁钉不会生锈 | |
| B. | 图②,若断开电源,钢闸门将发生吸氧腐蚀 | |
| C. | 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 | |
| D. | 图③,若金属M比Fe活泼,可防止输水管腐蚀 |
20. 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
(1)已知CA5为离子化合物,写出其电子式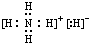 .
.
(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图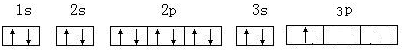 .
.
(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
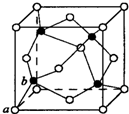
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
 现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:
现有8种元素,其中A、B、C、D、E、F为短周期主族元素,G、H为第四周期元素,它们的原子序数依次增大.请根据下列相关信息回答问题:| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的最外层电子数是最内层电子数的2倍 |
| C元素原子的核外p电子数比s电子数少1 |
| D 原子的第一至第四电离能分别是: I 1=578kJ•mol-1I 2=1817kJ•mol-1 I 3=2745kJ•mol-1I 4=11575kJ•mol-1 |
| E原子核外所有p轨道全满或半满 |
| F元素的主族序数与周期序数的差值为4 |
| G 是前四周期中电负性最小的元素 |
| H在周期表的第12列 |
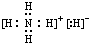 .
.(2)A、B、C三种元素可以形成原子个数比为1:1:1的3原子化合物分子,该分子中σ键和π键的个数比为1:1.
(3)画出D基态原子的核外电子排布图
 .
.(4)C与A形成最简单化合物的沸点高于E与A形成的化合物,其原因是NH3分子之间可以形成氢键.
(5)EF3中心原子的杂化方式为sp3;用价层电子对互斥理论推测其空间构型为三角锥形.
(6)检验G元素的方法是焰色反应;请用原子结构的知识解释产生此现象的原因当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子.电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将以光的形式释放能量.
(7)H与硫元素形成的化合物HS的晶体结构如图所示,其晶胞边长为x pm,则HS晶体的密度为$\frac{97×4}{{N}_{A}×(x×1{0}^{-10})^{3}}$g•cm-3(列式即可,阿伏加德罗常数用NA表示);a与b之间的距离为$\frac{1}{4}$×$\sqrt{3}$xpm(用含x的式子表示).
6.某实验小组对影响铝与盐酸反应的快慢的因素进行探究.下表是实验记录的数据.
(1)写出铝与盐酸反应的离子方程式:2Al+6H+=2Al3++3H2↑;
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
| 实验编号 | 盐酸的浓度 | 反应温度 | 铝片消失的时间 |
| ① | 0.1mol/L | 20℃ | 400s |
| ② | 0.2mol/L | 20℃ | 200s |
| ③ | 0.2mol/L | 30℃ | 50s |
(2)实验①与实验②探究浓度对反应速率的影响,实验②与实验③探究温度对反应速率的影响.请将表中空白处填写完整,由实验得出的结论是:其他条件不变时,反应物浓度越大,反应速率越快,反应温度越高,反应速率越快.
(3)若实验④盐酸浓度为0.4mol/L,反应温度为40℃,铝片消失的时间大约为6.25s.实验⑤盐酸浓度为0.2mol/L,温度为50℃,铝片消失的时间与实验④相比可能更短的是⑤(填编号)
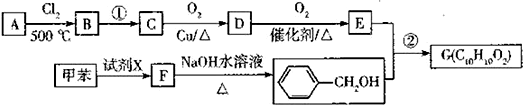
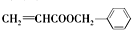 .
.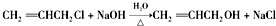 .
.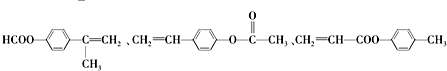 .
. .
.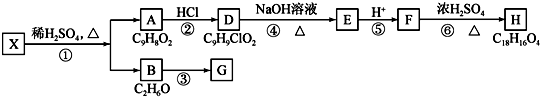
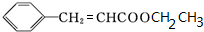 +H2O$→_{△}^{稀硫酸}$
+H2O$→_{△}^{稀硫酸}$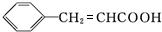 +CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.
+CH3CH2OH.检验A中非含氧官能团所用的试剂为溴水或溴的四氯化碳溶液.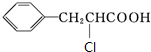 .
.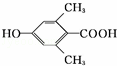 、
、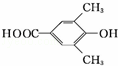 .
.