题目内容
18.某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果.实验Ⅰ(图1)
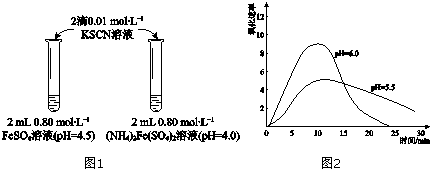
| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
FeSO4<(NH4)2Fe(SO4)2(填“>”或“<”).
(2)甲同学提出实验Ⅰ中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+,因为NH4+具有还原性.进行实验Ⅱ,否定了该观点,补全该实验.
| 操作 | 现象 |
| 取取2mLpH=4.0的0.80mol•L-1FeSO4溶液,加加2滴0.01mol•L-1KSCN溶液,观察. | 与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同. |
(4)进一步研究在水溶液中Fe2+的氧化机理.测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图2(实验过程中溶液温度几乎无变化).反应初期,氧化速率都逐渐增大的原因可能是生成的Fe(OH)3对反应有催化作用.
(5)综合以上实验,增强Fe2+稳定性的措施有加一定量的酸,密封保存.
分析 (1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+浓度相同,但中(NH4)2Fe(SO4)2含有浓度较高的NH4+;通过表格中的颜色变化来分析;
(2)由于是要验证两溶液的稳定性差异是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+导致,根据控制变量法可知,应除了让NH4+这个影响因素外的其它影响因素均保持一致,据此分析;
(3)由实验Ⅲ可知,溶液的pH越小,溶液的酸性越强,则Fe2+越稳定;亚铁盐溶液中存在反应4Fe2++O2+10H2O?4Fe(OH)3+8H+,根据平衡的移动来分析;
(4)根据影响反应速率的因素有浓度、压强、温度和催化剂来分析;
(5)根据上述实验来分析.
解答 解:(1)(NH4)2Fe(SO4)2溶液和FeSO4中的Fe2+浓度相同,但中(NH4)2Fe(SO4)2含有浓度较高的NH4+,NH4+水解显酸性,导致(NH4)2Fe(SO4)2中的pH更小;通过表格中的颜色变化可知(NH4)2Fe(SO4)2中的Fe2+被氧化的速率更慢,即溶液的稳定性:FeSO4<(NH4)2Fe(SO4)2,
故答案为:NH4++H2O?NH3•H2O+H+;<;
(2)由于是要验证两溶液的稳定性差异是否是由于(NH4)2Fe(SO4)2溶液中的NH4+保护了Fe2+导致,根据控制变量法可知,应除了让NH4+这个影响因素外的其它影响因素均保持一致,故应取2 mL pH=4.0的0.80 mol•L-1 FeSO4溶液于试管中,加2滴0.01 mol•L-1 KSCN溶液,过若观察到的现象与实验Ⅰ中(NH4)2Fe(SO4)2溶液现象相同,则说明上述猜想不正确,
故答案为:取2 mL pH=4.0的0.80 mol•L-1 FeSO4溶液;加2滴0.01 mol•L-1 KSCN溶液;
(3)由实验Ⅲ可知,溶液的pH越小,溶液的酸性越强,则Fe2+越稳定;亚铁盐溶液中存在反应4Fe2++O2+10H2O?4Fe(OH)3+8H+,溶液的pH越小,则氢离子浓度越大,平衡左移,则Fe2+的氧化被抑制,
故答案为:溶液pH越小,Fe2+越稳定;溶液中存在平衡4Fe2++O2+10H2O?4Fe(OH)3+8H+,c(H+)大,对平衡的抑制作用强,Fe2+更稳定;
(4)影响反应速率的因素有浓度、压强、温度和催化剂,而同一条曲线上的浓度FeSO4溶液相同,且应随着反应的进行,Fe2+的浓度减小,故不是浓度对反应速率的影响;而此反应为溶液中的反应,故压强对此反应速率无影响;而此反应中温度不变,故能影响反应速率的只有催化剂,故唯一的可能原因是生成的Fe(OH)3对反应有催化作用,故答案为:生成的Fe(OH)3对反应有催化作用;
(5)根据上述实验可知,加入一定量的酸会抑制Fe2+的氧化,或是隔绝空气密封保存,故答案为:加入一定量的酸,密封保存.
点评 本题考查了盐类的水解和探究影响Fe2+稳定性的因素,综合性较强,难度较大,应注意从影响反应速率和平衡的因素的角度来分析.

 阅读快车系列答案
阅读快车系列答案| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究比较改变不同反应物的浓度对反应速率的影响对化学反应速率的影响.
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为$\frac{3a}{5V}$ mol/(L•min).
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大.
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是催化剂(或硫酸锰或Mn2+的催化作用)的影响.
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B(填字母序号).
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
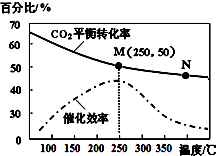 一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )
一定条件下合成乙烯:6H2(g)+2CO2(g)?CH2=CH2(g)+4H2O(g).已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法正确的是( )| A. | 生成乙烯的速率:v(M)有可能小于v(N) | |
| B. | 当温度高于250℃时,升高温度,平衡向逆反应方向移动,催化剂的催化效率降低 | |
| C. | 平衡常数:KM<KN | |
| D. | 若投料比n(H2):n(CO2)=3:1,则图中M点乙烯的体积分数为15.4% |
| A. | 维生素C有还原性 | |
| B. | 天然油脂有固定的熔沸点 | |
| C. | 麦芽糖水解产物为还原性糖 | |
| D. | 氨基酸既能与盐酸反应又能与NaOH溶液反应 |
| A. | 化学反应除了生成新的物质外,只伴随着热量的变化 | |
| B. | 物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生 | |
| C. | 太阳能、氢能、生物质能属于新能源 | |
| D. | 化石燃料是一次能源,乙醇是不可再生能源 |
| A. | 元素的原子核外电子排布呈周期性变化 | |
| B. | 元素主要化合价呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素的相对原子质量递增,量变引起质变 |
| A. | BeCl2 | B. | H2O | C. | HCHO | D. | CS2 |
| A. | Y的单质可从Z的盐溶液中置换出Z | |
| B. | 简单氮化物的热稳定性:X<W | |
| C. | 简单离子的半径:W>X>Y>Z | |
| D. | X分别与Y、Z形成的化合物中只含有离子键 |
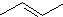 某有机物X的键线式为
某有机物X的键线式为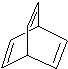 .
.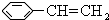 ,
, .
.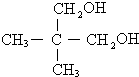 .
.