题目内容
 X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图所示.X.Y.Z的最外层电子数之和为14,下列说法中正确的是( )
X.Y.Z.W均为短周期元素,它们在元素周期表中的位置如图所示.X.Y.Z的最外层电子数之和为14,下列说法中正确的是( )| A、原子半径:W>Z>Y>X |
| B、W的单质能与水反应,生成一种具有漂白性的物质 |
| C、四种元素的氢化物中,Z的氢化物最稳定 |
| D、最高价氧化物对应水化物的酸性:W>Z>X |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W均为短周期元素,依据其所在表格中的相对位置知X、Y位于第二周期,Z、W位于第三周期,且X、Y、Z的最外层电子数之和为14,设X的最外层电子数为a,则Y为a+1,Z为a+1,即a+(a+1)+(a+1)=14,解a=4,据此得出X为碳,Y为氮,Z为磷,W为硫,据此判断各选项即可.
解答:
解:依据分析可知:X为C,Y为N,Z为P,W为S,
A、电子层越多,半径越大,同周期从左向右原子半径依次减小,则原子半径为Z>W>X>Y,故A错误;
B、S单质不能与水反应,故B错误;
C、C、N、P、S四种元素的氢化物中,N元素形成的氢化物(即氨气)最稳定,故C错误;
D、非金属性S>P>C,则最高价氧化物对应的水化物的酸性为H2SO4>H3PO4>H2CO3,故D正确,故选D.
A、电子层越多,半径越大,同周期从左向右原子半径依次减小,则原子半径为Z>W>X>Y,故A错误;
B、S单质不能与水反应,故B错误;
C、C、N、P、S四种元素的氢化物中,N元素形成的氢化物(即氨气)最稳定,故C错误;
D、非金属性S>P>C,则最高价氧化物对应的水化物的酸性为H2SO4>H3PO4>H2CO3,故D正确,故选D.
点评:本题主要考查的是位置-结构-性质的关系,推断元素是解答本题的关键,注意把握元素周期律的递变规律.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
与250mL 0.4mol?L-1稀硫酸中的c(H+)相等的是( )
| A、100 mL 2 mol?L-1的盐酸溶液 |
| B、25 mL 0.8 mol?L-1的稀HNO3溶液 |
| C、100 mL 1 mol?L-1的稀H2SO4溶液 |
| D、250 mL 0.4 mol?L-1的稀盐酸溶液 |
下列图示与对应的叙述相符的是( )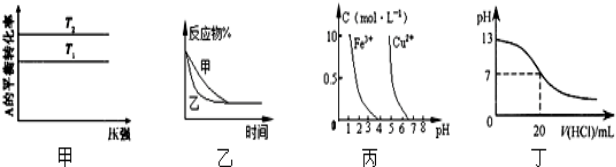

| A、图甲可以判断出反应A(g)+B(g)?2C(g)的△H<0,T2>T1 |
| B、图乙表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| C、依据图丙,若除去CuSO4溶液中的Fe3+,可向溶液中加入适量的CuO,调节pH≈4 |
| D、图丁表示25℃时,用0.1 mol/L 盐酸滴定20 ml 0.1mol/LNaOH溶液,溶液的pH随加入盐酸体积的变化 |
下列关于砷(As)元素的叙述中,正确的是( )
| A、在AsCl3分子中,砷原子最外层电子数为8 |
| B、Na3AsO4溶液的pH等于7 |
| C、砷的氢化物的化学式为AsH3,其还原性比NH3的弱 |
| D、第一电离能:As<Se |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 | ||
B、c(OH-)=
| ||
| C、使石蕊试液呈紫色的溶液 | ||
| D、c(H+)=10-7mol/L的溶液 |
下列溶液中的c(Cl-) 与150mL、1mol/LAlCl3 溶液中的c(Cl-) 相等的是( )
| A、150 mL、1 mol/L NaCl溶液 |
| B、25 mL、3 mol/L NH4Cl 溶液 |
| C、75 mL、2 mol/L MgCl2溶液 |
| D、75 mL、2 mol/L FeCl3溶液 |


