题目内容
25℃时,水中存在电离平衡:H2O?H++OH-△H>0.下列叙述正确的是( )
| A、将水加热,KW增大,pH不变 |
| B、向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
| C、向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D、向水中加入少量NaHSO4固体,c(H+)增大,KW不变 |
考点:离子积常数,水的电离
专题:电离平衡与溶液的pH专题
分析:水的电离是吸热反应,升高温度促进水电离,导致纯水中氢离子浓度增大,离子积常数增大,溶液的pH减小,酸、碱抑制水电离,含有弱离子的盐促进水电离,但离子积常数只与温度有关.
解答:
解:A.水的电离是吸热反应,升高温度促进水电离,导致纯水中氢离子浓度增大,离子积常数增大,溶液pH减小,故A错误;
B.向水中加入NH4Cl固体,铵根离子水解导致水平衡正向移动,c(OH-)减小,故B错误;
C.向水中加入少量NaOH固体,NaOH电离出的氢氧根离子抑制水电离,则水的平衡逆向移动,c(OH-)增大,故C错误;
D.向水中加入少量NaHSO4固体,c(H+)增大,溶液的pH减小,温度不变,KW不变,故D正确;
故选D.
B.向水中加入NH4Cl固体,铵根离子水解导致水平衡正向移动,c(OH-)减小,故B错误;
C.向水中加入少量NaOH固体,NaOH电离出的氢氧根离子抑制水电离,则水的平衡逆向移动,c(OH-)增大,故C错误;
D.向水中加入少量NaHSO4固体,c(H+)增大,溶液的pH减小,温度不变,KW不变,故D正确;
故选D.
点评:本题以水的离子积常数为载体考查水的电离,明确溶液中变化的离子确定水的电离平衡移动方向,注意离子积常数只与温度有关,与溶液酸碱性无关.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列说法错误的是( )
| A、用煤制取甲醚(CH3OCH3)替代石油,可以缓解我国石油的供需矛盾 |
| B、医疗上用的“钡餐”其成分是氯化钡 |
| C、氮化硅陶瓷、通讯光缆等都是新型无机非金属材料 |
| D、利用风能、生物能发电,将火力发电用煤进行脱硫处理,有利于环保 |
物质的量浓度相同的三种酸HX、HY、HZ的溶液,其pH依次为4、5、6,则KX、KY、KZ的碱性由强到弱的顺序是( )
| A、KX、KZ、KY |
| B、KX、KY、KZ |
| C、KZ、KY、KX |
| D、KY、KZ、KX |
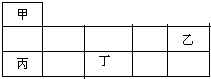 短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )
短周期金属元素甲~丁在元素周期表中的相对位置如图所示:下列判断正确的是( )| A、原子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均为共价化合物 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、53g Na2CO3晶体中含阴离子数目为0.5NA |
| B、25℃时,pH=7的NH4Cl和NH3?H2O混合溶液中,OH-离子数为10-7 NA |
| C、1 mol Cl2通入足量水中,转移的电子数是NA |
| D、100mL 1 mol/LAlCl3中的阳离子数为0.1NA |
下列反应中,属于取代反应的是( )
①CH3CH═CH2+Br2
CH3CHBrCH2Br
②C6H6+HNO3
C6H5NO2+H2O
③CH3CH2OH
CH2═CH2↑+H2O
④CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O.
①CH3CH═CH2+Br2
| CCl4 |
②C6H6+HNO3
| 浓H2SO4 |
| △ |
③CH3CH2OH
| 浓H2SO4 |
| △ |
④CH3COOH+CH3CH2OH
| 浓H2SO4 |
| △ |
| A、①② | B、③④ | C、①③ | D、②④ |