题目内容
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4?7H2O),过程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是 (填编号);
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)在①中已知FeS中铁元素生成Fe3+,写出FeS、O2、H2SO4反应的方程式 ;
(3)在③中,需加入的物质是 ;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有 ;
(5)在⑥中,将溶液Z控制到70~80℃的目的是 ;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g.若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数 Mr(BaSO4)=233Mr(Fe)=56.(写出计算过程,结果保留4位有效数字)

(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)在①中已知FeS中铁元素生成Fe3+,写出FeS、O2、H2SO4反应的方程式
(3)在③中,需加入的物质是
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有
(5)在⑥中,将溶液Z控制到70~80℃的目的是
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g.若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数 Mr(BaSO4)=233Mr(Fe)=56.(写出计算过程,结果保留4位有效数字)
考点:副产品的综合利用,二氧化硫的化学性质,含硫物质的性质及综合应用
专题:氧族元素
分析:(1)过程②产生的气体为SO2,具有还原性和漂白性;
(2)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)在⑥中,将溶液Z控制到70~80℃的目的为促进的水解,加热有利于水解的进行;
(6)根据n(Fe3+)=n(SO42-)计算.
(2)根据反应物和生成物的种类结合质量守恒书写化学方程式;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+;
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器;
(5)在⑥中,将溶液Z控制到70~80℃的目的为促进的水解,加热有利于水解的进行;
(6)根据n(Fe3+)=n(SO42-)计算.
解答:
解:(1)过程②产生的气体为SO2,具有还原性和漂白性,因具有漂白性而使品红褪色,因具有还原性而使具有氧化性的酸性KMnO4溶液、溴水褪色,只有紫色石蕊试液不会褪色.
故答案为:B;
(2)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,
故答案为:蒸发皿、玻璃棒;
(5)在⑥中,将溶液Z控制到70~80℃的目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:升高温度促进Fe3+的水解;
(6)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,
n(BaSO4)=
=0.015mol,
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=
×100%=31.11%,
故答案为:31.11%.
故答案为:B;
(2)反应物为FeS、O2和H2SO4,生成物有S,根据质量守恒还应有Fe2(SO4)3和H2O,反应的化学方程式为4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S,
故答案为:4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S;
(3)溶液X中含有Fe3+,要制备绿矾,应加入Fe使之还原为Fe2+,加入铁可生成Fe2+,并且不引入新的杂质,
故答案为:Fe(或铁);
(4)蒸发结晶需要使用酒精灯、三角架、蒸发皿、玻璃棒等仪器,可能还需要泥三角,
故答案为:蒸发皿、玻璃棒;
(5)在⑥中,将溶液Z控制到70~80℃的目的为促进的水解,加热有利于水解的进行,促进Fe3+的水解,
故答案为:升高温度促进Fe3+的水解;
(6)过滤、洗涤、干燥,称量,得固体质量为3.495g,应为BaSO4沉淀,
n(BaSO4)=
| 3.495g |
| 233g/mol |
则n(Fe3+)=n(SO42-)=0.015mol,
m(Fe)=0.015mol×56g/mol=0.84g,
ω(Fe)=
| 0.84g |
| 2.7g |
故答案为:31.11%.
点评:本题考查较为综合,涉及物质含量的测定、制备实验方案的设计等知识,题目难度较大,注意常见化学实验操作方法.

练习册系列答案
相关题目
 ,其一氯代物有
,其一氯代物有
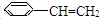 )5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空
)5种有机物分别在一定条件下与H2充分反应,按下列各题要求填空