题目内容
根据中学化学教材所附元素周期表判断,下列叙述错误的是( )
| A、第16列元素的最高价氧化物的化学式为RO3 |
| B、第2列元素中一定没有非金属元素 |
| C、第15列元素的最高价氧化物对应的水化物的化学式可能为H3RO4 |
| D、某元素的离子最外层电子数与次外层相同,该元素一定位于第三周期 |
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:A.第16列元素为氧族元素,最高价为+6价;
B.第2列元素,为碱土金属元素;
C.第15列元素,为氮族元素,最高价为+5价;
D.某元素的离子最外层电子数与次外层相同,可能为第四周期的元素,如K+.
B.第2列元素,为碱土金属元素;
C.第15列元素,为氮族元素,最高价为+5价;
D.某元素的离子最外层电子数与次外层相同,可能为第四周期的元素,如K+.
解答:
解:A.第16列元素为氧族元素,最高价为+6价,则元素最高价氧化物的化学式为RO3,故A正确;
B.第2列元素,为碱土金属元素,均为金属元素,故B正确;
C.第15列元素,为氮族元素,最高价为+5价,则元素的最高价氧化物对应的水化物的化学式可能为H3RO4,故C正确;
D.某元素的离子最外层电子数与次外层相同,可能为第四周期的元素,如K+,也可能为第三周期元素的阴离子,故D错误;
故选C.
B.第2列元素,为碱土金属元素,均为金属元素,故B正确;
C.第15列元素,为氮族元素,最高价为+5价,则元素的最高价氧化物对应的水化物的化学式可能为H3RO4,故C正确;
D.某元素的离子最外层电子数与次外层相同,可能为第四周期的元素,如K+,也可能为第三周期元素的阴离子,故D错误;
故选C.
点评:本题考查元素周期表的结构及应用,为高频考点,把握列与族序数的关系为解答的关键,注意族序数等于最外层电子数等于最高价,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式为C4H7Cl的同分异构体有( )
| A、14种 | B、15种 |
| C、16种 | D、17种 |
下列图标与回收内容不能对应的是( )
A、 玻璃 |
B、 瓜果壳 |
C、 电池 |
D、 剩饭菜 |
某金属单质能与足量浓硝酸反应,放出NO2气体,若参加反应的金属单质与硝酸的物质的量之比为1:a,则该金属元素在反应后生成的硝酸盐中的化合价是( )
| A、+2a | ||
| B、+a | ||
C、+
| ||
D、+
|
Fe与硝酸反应随温度和硝酸的浓度不同而产物不同.已知0.2mol HNO3做氧化剂时,恰好把0.4mol Fe氧化为Fe2+,则HNO3将被还原成( )
| A、NH4+ |
| B、N2O |
| C、NO |
| D、NO2 |
下列各组离子一定能大量共存的是( )
| A、含有大量Ba2+的溶液中:Cl、K+、SO42-、CO32- |
| B、含有大量H+的溶液中:Mg2+、Na+、HCO3-、SO42- |
| C、含有大量OH-的溶液中:NH4+、NO3、SO42-、CO32- |
| D、含有大量Na+的溶液中:H+、K+、SO42-、NO3- |
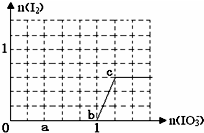 已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b-c间I2是既是还原产物又是氧化产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |