题目内容
8.可逆反应A(g)+3B(g)?2C(g),取2mol/L A和5 mol/L B置于一个5L的密闭容器中,2 min后,测得容器内A的浓度为1.6 mol/l.这2min内A和B的平均反应速率分别是多少?此时,容器内C的物质的量是多少?分析 平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则v=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,据此计算B、C的平均反应速率;同一可逆反应同一时间内参加反应的各物质浓度之比等于计量数之比,据此计算平衡时容器内C物质的量的物质的量.
解答 解:平衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,则v=$\frac{△c}{△t}$=$\frac{0.4mol/L}{2min}$=0.2mol/(L.min),同一可逆反应同一时间内各物质的反应速率之比等于其计量数之比,
则B的平均反应速率=3v=3×0.2mol/(L.min)=0.6mol/(L.min),
C的平均反应速率=2v=2×0.2mol/(L.min)=0.4mol/(L.min),
同一可逆反应同一时间内参加反应的各物质浓度之比等于计量数之比,衡时参加反应的△c(A)=(2-1.6)mol/L=0.4mol/L,参加反应的A、C的物质的量浓度之比为1:2,所以平衡时容器内C物质的量浓度=2△c(A)=2×0.4mol/L=0.8mol/L,物质的量=0.8mol/L×5l=4mol,
答:这2min内B、C的平均反应速率分别是0.6mol/(L.min)、0.4mol/(L.min);平衡时容器内C的物质的量的浓是0.4mol.
点评 本题考查化学平衡有关计算,侧重考查学生分析计算能力,利用三段式法结合各物质的关系式解答即可,题目难度不大.

练习册系列答案
相关题目
18.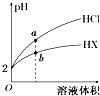 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | a、b两点:c(X-)>c(Cl-) | B. | 稀释10倍,HX溶液的pH=3 | ||
| C. | 稀释前,c(HX)=0.01 mol•L-1 | D. | 溶液的导电性:a>b |
16.下列对于溴乙烷、乙醇消去反应的叙述中正确的是( )
| A. | 反应条件相同 | B. | 产物中的有机化合物相同 | ||
| C. | 都生成水 | D. | 都使用温度计 |
3.基态原子的4s能级中只有1个电子的元素共有( )
| A. | 1 种 | B. | 2 种 | C. | 3 种 | D. | 8 种 |
13.甲、乙、丙、丁四种易溶于水的物质分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成.已知:
①向甲溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成;
②丙将溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
③1mol/L丁溶液中c(H+)=2mol/L.
下列结论不正确的是( )
①向甲溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成;
②丙将溶液分别与其它三种物质的溶液混合,均有白色沉淀生成;
③1mol/L丁溶液中c(H+)=2mol/L.
下列结论不正确的是( )
| A. | 甲溶液含有Cl- | B. | 乙溶液含有Mg2+ | C. | 丙溶液含有Ba2+ | D. | 丁溶液含有SO42- |
20.下列各组中的两个反应所属反应类型相同的是( )
| A. | 光照甲烷和氯气的混合气体,混合气体颜色变浅;乙烯能使溴水褪色 | |
| B. | 乙炔在氧气中燃烧;乙烯能使酸性高锰酸钾溶液褪色 | |
| C. | 工业上由乙烯和水反应生成乙醇;由苯与液溴反应生成溴苯 | |
| D. | 由乙烯制取聚乙烯;由苯制取硝基苯 |
18.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和C60的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 水和氯化钠的电解 |