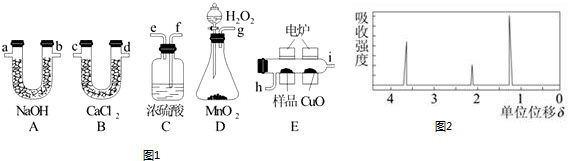
题目内容
7.写出下列物质的电子式:(1)N2

(2)KCl

(3)Na2S

(4)CO2
 .
.
分析 (1)氮气中存在3对共用电子对,氮原子最外层达到8个电子;
(2)氯化钾为离子化合物,钾离子与氯离子通过离子键结合;
(3)硫化钠是离子化合物,硫化钠的电子式中含有两个钠离子;
(4)CO2 中C分别为O形成2对共价键,属于共价化合物;
解答 解:(1)氮气中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ;
;
故答案为: ;
;
(2)KCl存在钾离子和氯离子,钾离子为简单阳离子,氯离子最外层为8电子,氯化钾的电子式为 ,
,
故答案为: ;
;
(3)硫化钠的化学式中含有两个钠离子,硫化钠正确的电子式为: ,
,
故答案为: ;
;
(4)CO2 中C分别为O形成2对共价键,电子式为: ,
,
故答案为: .
.
点评 本题考查了电子式的书写,明确离子化合物与共价化合物的电子式的表示方法及区别是解题关键,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
17.下列各组物质的性质比较,不正确的是( )
| A. | 酸性:HClO4>H3PO4>H2SO4 | B. | 氢化物稳定性:HF>H2O>NH3 | ||
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | D. | 氧化性:F2>O2>N2 |
18.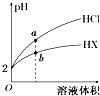 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
 25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示.下列说法正确的是( )| A. | a、b两点:c(X-)>c(Cl-) | B. | 稀释10倍,HX溶液的pH=3 | ||
| C. | 稀释前,c(HX)=0.01 mol•L-1 | D. | 溶液的导电性:a>b |
15.下列有关“氢化锂三兄弟”--LiH、LiD、LiT的叙述中正确的是( )
| A. | 三种物质质子数之比为1:2:3 | B. | 三种物质中子数之比为1:1:1 | ||
| C. | 三种物质的摩尔质量之比为8:9:10 | D. | 三种物质的化学性质不同 |
2.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中,第一电离能最小的是②(填编号);
(2)元素⑨和⑩形成的化合物的化学式为Si3N4;元素⑦的原子价电子排布式是3s23p5;
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是π键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是SO2(填分子式);
(4)根据对角线规则,Be与元素④的最高价氧化物的水化物的性质相似,它们都具有两性,显示这种性质的离子方程式是Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
(5)由以上某些元素形成的有机物苯酚(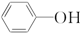 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子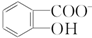 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
| 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中,第一电离能最小的是②(填编号);
(2)元素⑨和⑩形成的化合物的化学式为Si3N4;元素⑦的原子价电子排布式是3s23p5;
(3)元素③有一种单质为O3,其分子呈V形结构,键角116.5°.三个原子以一个为中心,与另外两个原子分别构成一个非极性键,中心原子再提供2个电子,旁边两原子各提供一个电子构成一个特殊的共价键--三个原子均等地享有这四个电子,这种特殊的共价键的类型是π键(填σ或π),在高中化学中有一种常见分子的结合方式与O3相同,它是SO2(填分子式);
(4)根据对角线规则,Be与元素④的最高价氧化物的水化物的性质相似,它们都具有两性,显示这种性质的离子方程式是Be(OH)2+2H+═Be2++2H2O、Be(OH)2+2OH-═BeO22-+2H2O;
(5)由以上某些元素形成的有机物苯酚(
 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是 中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
中形成分子内氢键,使其更难电离出H+;水杨酸分子中苯环和羧基上碳原子的杂化方式分别是sp2杂化和sp2杂化.
16.下列对于溴乙烷、乙醇消去反应的叙述中正确的是( )
| A. | 反应条件相同 | B. | 产物中的有机化合物相同 | ||
| C. | 都生成水 | D. | 都使用温度计 |