题目内容
17.下列化学方程式正确的是( )| A. | Cu+2HCl═CuCl2+H2↑ | B. | Al2O3+3H2O═2Al(OH)3 | ||
| C. | Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ MgO+H2O | D. | Ba(OH)2+SO2═BaSO4↓+H2O |
分析 A、金属铜和盐酸之间不会发生反应;
B、氧化铝和水之间不会发生反应;
C、氢氧化镁受热分解为氧化镁和水;
D、二氧化硫属于酸性氧化物,能和碱反应生成盐和水.
解答 解:A、金属铜和盐酸之间不会发生反应,故A错误;
B、氧化铝和水互不相溶,二者不会发生反应,故B错误;
C、氢氧化镁受热分解为氧化镁和水,即Mg(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O,故C正确;
D、二氧化硫属于酸性氧化物,能和碱氢氧化钡反应生成盐和水Ba(OH)2+SO2═BaSO3↓+H2O,故D错误.
故选C.
点评 本题考查学生物质的性质以及化学方程式的书写知识,属于基本知识的考查,难度不大.

练习册系列答案
相关题目
7.实验表明,在一定条件下,乙烯和水的反应可表示为:C2H4(g)+H2O (g)=C2H5OH(g)△H=-45.8kJ/mol,则下列说法中正确的是( )
| A. | 实验中,乙烯的用量不会影响该反应的反应焓变△H | |
| B. | 0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ | |
| C. | 1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和 | |
| D. | 1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能 |
5.${\;}_{53}^{131}{I}$是常规核裂变产物之一,可以通过测定大气或水中${\;}_{53}^{131}{I}$的含量变化来检测核电站是否发生放射性物质泄漏.下列有关${\;}_{53}^{131}{I}$的叙述中正确的是( )
| A. | ${\;}_{53}^{131}{I}$的原子核内中子数多于质子数 | |
| B. | ${\;}_{53}^{131}{I}$的原子序数为131 | |
| C. | ${\;}_{53}^{131}{I}$的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}{I}$的化学性质与${\;}_{53}^{127}{I}$不同 |
12.四种因素:①温度和压强 ②所含微粒数 ③微粒本身大小 ④微粒间的距离,其中对气态物质体积有显著影响的是( )
| A. | ②③④ | B. | ②④ | C. | ①③④ | D. | ①②④ |
2.某小组拟用含稀硫酸的KMnO4溶液与H2C2O4溶液(弱酸)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如表的方案记录实验结果(忽略溶液混合体积变化).限选试剂和仪器:0.20 mol/LH2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
回答下列问题:
(1)完成上述反应原理的化学反应方程式:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O
(2)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填写t溶液褪色时间/s.上述实验②④是探究催化剂对化学反应速率的影响.
(3)已知草酸为二元弱酸,其两级的电离方程式分别为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+;
(4)为了观察紫色褪去,草酸与高锰酸钾初始的物质的量需要满足的关系
n(H2C2O4):n (KMnO4)最小为:2.5(或5:2).
| 物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | V(蒸馏水)/mL | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4 固体)/g | T/℃ | 乙 |
| ① | 2.0 | 0 | 4.0 | 0 | 50 | |
| ② | 2.0 | 0 | 4.0 | 0 | 25 | |
| ③ | 1.0 | a | 4.0 | 0 | 25 | |
| ④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
(1)完成上述反应原理的化学反应方程式:5H2C2O4+2KMnO4+3H2SO4═10CO2↑+2MnSO4+K2SO4+8H2O
(2)上述实验①②是探究温度对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则 a为1.0;乙是实验需要测量的物理量,则表格中“乙”应填写t溶液褪色时间/s.上述实验②④是探究催化剂对化学反应速率的影响.
(3)已知草酸为二元弱酸,其两级的电离方程式分别为:H2C2O4?HC2O4-+H+、HC2O4-?C2O42-+H+;
(4)为了观察紫色褪去,草酸与高锰酸钾初始的物质的量需要满足的关系
n(H2C2O4):n (KMnO4)最小为:2.5(或5:2).
9.与纯水的电离相似,液氨中存在着微弱的电离:2NH3?NH4++NH2-,以下叙述中正确的是( )
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
6.工业上以CuFeS2为原料冶炼铜的主要反应为①2CuFeS2+4O2═Cu2S+3SO2+2FeO (炉渣);②2Cu2S+3O2═2Cu2O+2SO2;③2Cu2O+Cu2S=6Cu+SO2↑.下列说法错误的是( )
| A. | 由 1 mol CuFeS2 生成 1mol Cu,共消耗 2.75 molO2 | |
| B. | 该冶炼方法中产生大量的有害气体SO2,可回收用于制备硫酸 | |
| C. | 在反应③中,Cu2S既是氧化剂,又是还原剂 | |
| D. | 在反应①中,SO2既是氧化产物,又是还原产物 |
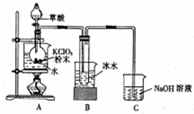 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示: